Bạn đang xem bài viết BaCl2 có kết tủa không? Tính chất Hóa học của BaCl2 tại Mas.edu.vn bạn có thể truy cập nhanh thông tin cần thiết tại phần mục lục bài viết phía dưới.
BaCl2 là một hợp chất hóa học thường được sử dụng trong nhiều ngành công nghiệp và hóa học. Đặc biệt, điều này hấp dẫn sự quan tâm của nhiều người là khả năng tạo ra kết tủa khi BaCl2 được pha phối với các chất khác. Trong bài viết này, chúng ta sẽ tìm hiểu về tính chất hóa học của BaCl2 và xem liệu có hay không có kết tủa xảy ra khi nó tương tác với các chất khác.
Trong hóa học, BaCl2 là một hợp chất được sử dụng khá nhiều. Thế nhưng ít ai biết BaCl2 có kết tủa không. Hãy cùng Mas.edu.vn tìm hiểu về loại muối này nhé.
BaCl2 có kết tủa không?
BaCl2 là gì? Bari Clorua là gì?
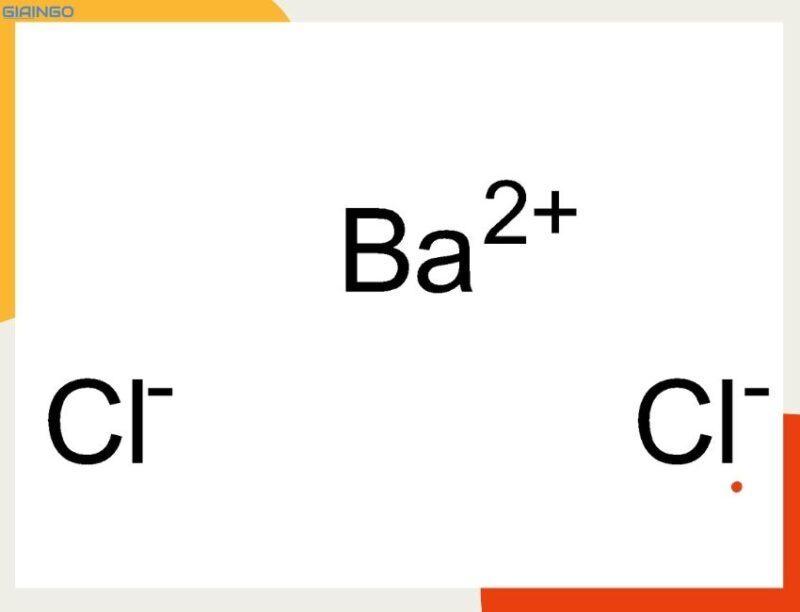
BaCl2 là công thức hóa học của hợp chất vô cơ với tên gọi là Bari Clorua. BaCl2 còn có tên gọi khác là Barium Chloride.
BaCl2 là một trong những loại muối hòa tan trong nước phổ biến nhất của bari.
Công thức cấu tạo của BaCl2 là Cl – Ba – Cl.
BaCl2 có kết tủa không?
BaCl2 có kết tủa. Kết tủa của BaCl2 có màu trắng.
Trường hợp 1: Cho vài giọt H2SO4 vào BaCl2, thấy xuất hiện kết tủa trắng, không tan trong axit.
Phương trình hóa học: BaCl2 + H2SO4 → BaSO4 + 2HCl.
Trường hợp 2: Cho BaCl2 phản ứng với dung dịch MnSO4 hoặc MgSO4. Khi kết hợp cùng các hợp chất này cũng tạo kết tủa trắng.
Phương trình hóa học:
BaCl2 + MnSO4 → MnCl2 + BaSO4.
BaCl2 + MgSO4 → MgCl2 + BaSO4.
Xem thêm:
- AgF có kết tủa không? Tính chất của AgF Hóa học lớp 10
- CuSO4 có kết tủa không? Một số ứng dụng của đồng sunfat CuSO4
- Ag2CO3 kết tủa màu gì? Ứng dụng của Ag2CO3 trong cuộc sống
Đặc tính của BaCl2
Bên trên bạn đã được tìm hiểu BaCl2 có kết tủa không. Tiếp theo, chúng ta cùng đến với những đặc tính của BaCl2 nhé.
Tính chất Vật lý của BaCl2
Có 3 tính chất Vật lý của BaCl2:
- Chất rắn, có màu trắng và tan tốt trong nước.
- Có độc.
- Đốt cho ngọn lửa màu xanh lá cây sáng.
Tính chất Hóa học của BaCl2
- BaCl2 tác dụng với muối
Phương trình hóa học:
BaCl2 + 2AgNO3 → 2AgCl + Ba(NO3)2.
BaCl2 + CuSO4 → BaSO4 + CuCl2.
- BaCl2 tác dụng với axit
Phương trình hóa học: BaCl2 + H2SO4 → BaSO4 + 2HCl.

Cách điều chế muối Bari Clorua BaCl2
Điều chế muối Bari Clorua BaCl2 trong phòng thí nghiệm
Người ta điều chế từ Ba(OH)2 hoặc BaCo3 để điều chế muối Bari Clorua BaCl2. Những muối này phản ứng với HCl để tạo ra BaCl2 ngậm nước.
Các phương trình hóa học xảy ra:
- CaCl2 + BaS → BaCl2 + CaS.
- CaCl2 + Ba(HCO3)2 → BaCl2 + CaCO3 + H2O + CO2.
- Ba(OH)2 + HCl → BaCl2 + H2O.
Điều chế muối Bari Clorua BaCl2 trong công nghiệp
- Bước 1: BaSO4(s) + 4 C(s) → BaS(s) + 4 CO(g).
- Bước 2: BaS + CaCl2 → BaCl2 + CaS.

Ứng dụng muối BaCl2
Ngoài những câu hỏi như BaCl2 có kết tủa không thì cách ứng dụng muối BaCl2 cũng được nhiều người tìm kiếm. Mời bạn cùng tham khảo nội dung dưới đây.
Ứng dụng muối BaCl2 trong phòng thí nghiệm
Ứng dụng muối BaCl2 trong phòng thí nghiệm kiểm tra sự có mặt của ion sunfat. Đây là loại muối có giá thành khá rẻ, tan nhiều trong nước nên chúng được sử dụng khá rộng rãi trong phòng thí nghiệm.
Ứng dụng muối BaCl2 trong công nghiệp
- Ứng dụng muối BaCl2 trong công nghiệp như để tinh chế dung dịch nước muối trong các nhà máy clorua caustic.
- Đồng thời BaCl2 còn dùng trong sản xuất muối xử lý nhiệt, thép, bột màu, và các muối bari khác.
- BaCl2 cũng được dùng trong pháo hoa để tạo màu xanh lá cây. Tuy nhiên vì BaCl2 có tính độc nên bị hạn chế ứng dụng này.
- Muối BaCl2 còn dùng để sản xuất thuốc trừ sâu, thuốc diệt chuột.
- BaCl2 giúp loại bỏ CaSO4 trong nước hồ bơi.
Bảo quản và sử dụng an toàn BaCl2
Có các cách bảo quản và sử dụng an toàn BaCl2 được Mas.edu.vn gợi ý cho bạn như sau:
- Nên để BaCl2 ở những nơi khô ráo, thoáng mát.
- Không nên bảo quản và xử lý BaCl2 bằng acid và các chất oxi hóa.
- BaCl2 rất độc. Cần sử dụng Na2SO4 và MgSO4 để giải độc vì hai chất này khi kết hợp với BaCl2 tạo thành BaSO4 không tan, tương đối không độc hại.
Với những thông tin vừa rồi hy vọng bạn đã tự trả lời được câu hỏi BaCl2 có kết tủa không. Cùng theo dõi Mas.edu.vn để đọc thêm nhiều kiến thức hóa học bổ ích nhé.
Trong chủ đề “BaCl2 có kết tủa không? Tính chất Hóa học của BaCl2”, ta có thể kết luận như sau:
BaCl2 là công thức hóa học của hợp chất muối clorua ba. BaCl2 tồn tại dưới dạng bột màu trắng và có tính tan trong nước. Khi hòa tan trong nước, BaCl2 sẽ tạo thành các ion Ba2+ và 2 ion Cl-.
Tuy nhiên, khi BaCl2 pha loãng trong nước, các ion Cl- sẽ hiện diện dễ dàng nhưng ion Ba2+ sẽ tương đối khó liên kết vào nước. Do đó, trong điều kiện pha loãng thì phần lớn các phân tử BaCl2 sẽ không kết tủa và duy trì ở trạng thái dung dịch.
Tuy nhiên, điều kiện pha đặc và sự có mặt của các ion Cl- trong dung dịch sẽ tạo ra hiện tượng kết tủa trong trường hợp tiếp xúc với các ion có khả năng tạo phức hoặc trường hợp tạo chất đệm. Trong trường hợp này, các ion Ba2+ sẽ kết hợp với các ion Cl- để tạo thành các phân tử BaCl2 kết tủa.
Tóm lại, BaCl2 có khả năng hòa tan trong nước và không kết tủa trong điều kiện pha loãng. Tuy nhiên, nếu có mặt các ion khác có khả năng tạo phức hoặc trong trường hợp tạo chất đệm, BaCl2 có thể kết tủa. Tính chất hóa học của BaCl2 bao gồm tương tác với các chất khác để tạo ra kết tủa hoặc hòa tan, và khả năng tạo phức trong môi trường nước.
Cảm ơn bạn đã xem bài viết BaCl2 có kết tủa không? Tính chất Hóa học của BaCl2 tại Mas.edu.vn bạn có thể bình luận, xem thêm các bài viết liên quan ở phía dưới và mong rằng sẽ giúp ích cho bạn những thông tin thú vị.
Từ Khoá Liên Quan:
1. BaCl2
2. Kết tủa
3. Tính chất Hoá học
4. Kết tinh
5. Kết tủa lưỡng tuyến
6. Hòa tan
7. Phản ứng hóa học
8. Tính chất vật lý
9. Tạo kết tủa
10. Phân li
11. Kết tủa trong nước
12. Kết tủa trong dung dịch
13. Kết tủa không tan
14. Kết tủa trong hóa học
15. Dẫn xuất BaCl2.