Bạn đang xem bài viết Silic là kim loại hay phi kim? Bài tập Hóa học lớp 9 tại Mas.edu.vn bạn có thể truy cập nhanh thông tin cần thiết tại phần mục lục bài viết phía dưới.
Silic là một chất vô cơ quan trọng trong lĩnh vực hóa học. Tuy nhiên, khi nói đến tính chất của silic, câu hỏi phổ biến được đặt ra là liệu nó có phải là một kim loại hay một phi kim? Trong bài viết này, chúng ta sẽ khám phá và tìm hiểu về silic để có cái nhìn rõ ràng hơn về tính chất hóa học của nó.
Rất nhiều điểm thú vị về nguyên tố độc đáo Silic, từ những ứng dụng thường ngày cho tới cả sự sống ngoài trái đất. Vậy Silic là kim loại hay phi kim cùng Mas.edu.vn giải đáp nhé!
Danh Mục Bài Viết
Silic là kim loại hay phi kim?
Trước khi giải đáp câu hỏi thắc mắc của độc giả Silic là kim loại hay phi kim. Thì cùng Mas.edu.vn tìm hiểu sơ về khái niệm Silic nhé!
Silic là gì?
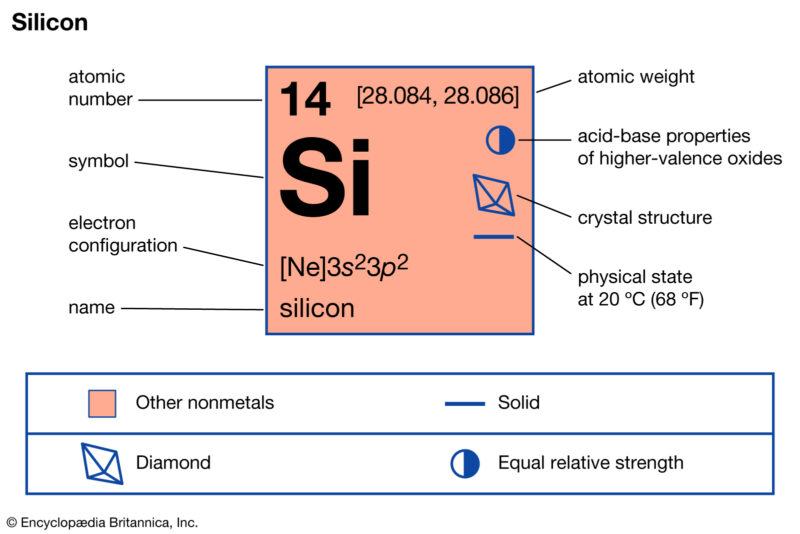
Silic là nguyên tố có nhiều trong vỏ trái đất. Silic là nguyên tố thứ 2 sau oxi chiếm 1/4 khối lượng vỏ trái đất.
Trong thiên nhiên, silic không tồn tại ở dạng đơn chất mà chỉ ở dạng hợp chất như cát trắng, đất sét (cao lanh).

Silic là kim loại hay phi kim?
Silic có đặc tính của cả kim loại cũng như phi kim nên chúng thường được gọi là chất bán dẫn. Silic dẫn điện tốt hơn khi nhiệt độ tăng lên (ngược lại với các kim loại thông thường).
Tính chất vật lý của Silic
Tính chất vật lý của Silic được thể hiện qua những ý sau:
- Có các dạng thù hình: silic tinh thể và silic vô định hình.
- Silic tinh thể có cấu trúc giống kim cương, màu xám, có ánh kim, có tính bán dẫn, nóng chảy ở 1420oC.
- Silic vô định hình là chất bột màu nâu.
Tính chất hóa học của Silic
Khi đã nắm được vững thông tin về Silic là kim loại hay phi kim. Cùng Mas.edu.vn làm rõ hơn những tính chất hóa học riêng của Silic nhé!
Các mức oxi hóa có thể có của Si: -4; 0; +2; +4 (số oxi hóa +2 ít đặc trưng). Đa dạng tính oxi hóa nên Si có cả tính khử và tính oxi hoá.
Silic vô định hình có khả năng phản ứng cao hơn Silic tinh thể.
Silic thể hiện tính khử
- Silic tác dụng với phi kim:
- Si + 2F2 → SiF4 (phản ứng xảy ra ở nhiệt độ thường).
- Si + O2 → SiO2
- Silic tác dụng với hợp chất:
- Si tan dễ dàng trong dung dịch kiềm → H2
- Si + 2NaOH + H2O → Na2SiO3 + 2H2↑
- Si tác dụng với axit:
- 4HNO3 + 18HF + 3Si → 3H2SiF6 + 4NO + 8H2O
- Trong hồ quang điện, Silic tác dụng với H2 tạo thành một hỗn hợp các Silan:
- Si + H2 → SiH4 + Si2H6 + Si3H6 + …
Silic thể hiện tính oxi hóa
Si tác dụng được với nhiều kim loại ở nhiệt độ cao → Silixua kim loại.
- 2Mg + Si → Mg2Si
Thuộc tính của Silic là gì?
Trong dạng tinh thể, Silic có màu xám sẫm ánh kim. Mặc dù là một nguyên tố tương đối trơ, Silic vẫn có phản ứng với các halogen và các chất kiềm loãng.
Silic nguyên tố truyền khoảng hơn 95% các bước sóng hồng ngoại. Tinh thể Silic nguyên chất hiếm tìm thấy trong tự nhiên thông thường nó nằm trong dạng SiO2.
Các tinh thể Silic nguyên chất tìm thấy trong tạp chất của vàng hay dung nham núi lửa nó có hệ số kháng nhiệt âm. Silic thể hiện tính chất hóa học kém hơn cacbon là nguyên tố tương tự nó về mặt hóa học.
Nó có trong đất sét, fenspat, granit thạch anh và cát. Chủ yếu trong dạng điôxit Silic (hay Silica) và các Silicat.

Điều chế Silic như thế nào?
Trong phòng thí nghiệm: Có thể theo 2 cách sau
- SiCl4 + 2Zn → Si + 2ZnCl2
- SiO2 + 2Mg → Si + 2MgO
Trong công nghiệp:
Silic được điều chế trong công nghiệp bằng cách dùng chất khử mạnh như cacbon để khử SiO2 ở nhiệt độ cao.
PTHH: SiO2 + 2C → Si + 2CO
Ứng dụng của Silic trong cuộc sống hiện nay
Ứng dụng của Silic trong cuộc sống hiện nay như:
- Silic là vật liệu chịu lửa sử dụng trong sản xuất như gốm hay men sứ.
- Silic là thành phần quan trọng trong một số loại thép.
- Phần lớn đồng thau được sản xuất có chứa hợp kim của đồng với Silic.
Silic là nguyên tố rất có ích và cực kỳ cần thiết trong nhiều ngành công nghiệp. Silic là nguyên tố rất quan trọng cho thực vật và động vật.

Bài tập về Silic trong SGK Hóa học 9
Bài 1 trang 95 SGK Hóa học 9
Hãy nêu đặc điểm của nguyên tố silic về trạng thái tự nhiên, tính chất và ứng dụng.
Lời giải:
Trạng thái tự nhiên:
- Silic là nguyên tố phổ biến thứ hai trong thiên nhiên, chỉ sau oxi. Silic chiếm ¼ khối lượng vỏ Trái Đất.
- Trong tự nhiên, silic không tồn tại ở dạng đơn chất mà chỉ tồn tại ở dạng hợp chất. Các hợp chất tồn tại nhiều là thạch anh, cát trắng, đất sét (cao lanh).
Tính chất:
- Tính chất vật lí:
- Silic là chất rắn, màu xám, khó nóng chảy, có vẻ sáng của kim loại, dẫn điện kém.
- Silic là chất bán dẫn.
- Tính chất hóa học: Phản ứng với oxi (ở nhiệt độ cao): Si + O2 → SiO2.
Ứng dụng:
Silic được sử dụng trong kĩ thuật rađio, trong chế tạo pin mặt trời, chế tạo linh kiện điện tử,…
Bài 2 trang 95 SGK Hóa học 9
Hãy mô tả sơ lược các công đoạn chính để sản xuất đồ gốm.
Lời giải:
- Nguyên liệu: Đất sét, thạch anh, fenpat.
- Các công đoạn chính:
- Nhào đất sét, thạch anh và fenspat với nước để tạo thành bột dỏe rồi tạo hình, sấy khô thành các đồ vật.
- Cho vào lò nung với nhiệt độ thích hợp.
Bài 3 trang 95 SGK Hóa học 9
Thành phần chính của xi măng là gì? Cho biết nguyên liệu chính và mô tả sơ lược các công đoạn sản xuất xi măng.
Lời giải:
- Thành phần của xi măng là canxi silicat và canxi aluminat.
- Nguyên liệu chính: Đất sét, đá vôi, cát,…
- Những công đoạn chính trong sản xuất xi măng:
- Nghiền nhỏ đá vôi, đất sét và quặng sắt rồi trộn với nước thành dạng bùn.
- Nung hỗn hợp đất sét, đá vôi và quặng sắt trong lò quay hoặc lò đứng ở nhiệt độ khoảng 1400 – 1500oC thu được clanhke rắn.
Bài 4 trang 95 SGK Hóa học 9
Sản xuất thủy tinh như thế nào? Viết các phương trình phản ứng hóa học xảy ra trong quá trình nấu thủy tinh.
Lời giải:
Sản xuất thủy tinh:
- Trộn hỗn hợp cát, đá vôi, sôđa theo tỉ lệ thích hợp.
- Nung hỗn hợp trong lò nung ở khoảng 900oC.
- Làm nguội từ từ được thủy tinh dẻo, ép thổi thủy tinh thành các đồ vật.
PTHH:
- CaCO3 → CaO + CO2↑
- CaO + SiO2 → CaSiO3
- Na2CO3 + SiO2 → Na2SiO3 + CO2.
Thành phần chính của thủy tinh thường là Na2SiO3 và CaSiO3.
Xem thêm:
- Tính chất hoá học của muối là gì? Bài tập Hoá lớp 9
- Tính chất hóa học của axit? 5 ứng dụng axit phổ biến nhất
- Tính chất hóa học của oxit? Khái quát về 4 loại oxit đặc trưng
Chúng ta đã vừa tìm hiểu về Silic là kim loại hay phi kim và những ứng dụng của Silic trong đời sống hiện nay. Hi vọng bài viết của Mas.edu.vn đã giúp ích cho các bạn.
Dựa vào những kiến thức về hóa học đã học, ta có thể kết luận rằng silic không phải là kim loại mà là phi kim. Có nhiều yếu tố chính để chứng minh điều này.
Đầu tiên, kim loại thường có tính kim loại, tức là chúng dẻo, có điện tích dương, dẫn điện và dẫn nhiệt tốt. Tuy nhiên, silic không có những tính chất này. Thay vào đó, silic có cấu trúc tinh thể phân tử với liên kết cộng hóa trị mạnh giữa nguyên tử silic. Điều này dẫn đến tính chất cứng, mạnh và giữa liên kết của silic không thể truyền điện năng hoặc điện tử giống như kim loại.
Thứ hai, silic không có tính chất malleable hoặc dẻo như nhiều kim loại khác. Kim loại thường có thể bị uốn cong hoặc kéo dãn thành các hình dạng khác nhau mà không bị gãy hay vỡ. Silic không có khả năng này và thậm chí là vô địch mạnh mẽ – không thay đổi hình dạng nếu bị áp lực.
Cuối cùng, silic không có tính chất dẫn điện như kim loại. Kim loại thường có khả năng dẫn điện cao do sự tồn tại của các electron dẫn tự do trong cấu trúc của chúng. Ngược lại, silic là vật liệu bán dẫn và không có chất chuyển dẫn điện tử mạnh mẽ.
Vì những lý do trên, silic được xem là phi kim. Mặc dù có một số tính chất khác nhau so với kim loại, silic đóng vai trò quan trọng trong nhiều lĩnh vực như điện tử và công nghệ thông tin nhờ vào phẩm chất đặc biệt của nó.
Cảm ơn bạn đã xem bài viết Silic là kim loại hay phi kim? Bài tập Hóa học lớp 9 tại Mas.edu.vn bạn có thể bình luận, xem thêm các bài viết liên quan ở phía dưới và mong rằng sẽ giúp ích cho bạn những thông tin thú vị.
Từ Khoá Liên Quan:
1. Silic
2. Kim loại
3. Phi kim
4. Silicon
5. Tinh thể
6. Chất lỏng
7. Khoáng chất
8. Nguyên tố
9. Hóa học
10. Cạnh kim
11. Điểm nóng chảy
12. Điện trở
13. Điện di
14. Phủa kim
15. Phototđiễn