Bạn đang xem bài viết Sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học? Định luật tuần hoàn tại Mas.edu.vn bạn có thể truy cập nhanh thông tin cần thiết tại phần mục lục bài viết phía dưới.
Sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học là một chủ đề quan trọng trong lĩnh vực hoá học. Qua nhiều nghiên cứu và quan sát, các nhà khoa học đã phát hiện ra một quy luật tồn tại trong sự biến đổi này, được gọi là định luật tuần hoàn.
Định luật tuần hoàn trong hoá học là một công cụ quan trọng giúp hiểu rõ hơn về tính chất và cấu trúc của các nguyên tố hóa học. Theo định luật này, các nguyên tố được sắp xếp theo thứ tự tăng dần của số nguyên tử trong bảng tuần hoàn Mendeleev. Sự sắp xếp này giúp xác định các mẫu chung trong tính chất của các nguyên tố, cung cấp cơ sở cho các dự đoán về tính chất của các nguyên tố chưa được khám phá.
Sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học như độ âm điện, bán kính nguyên tử, năng lượng ion hóa, và khả năng tạo liên kết hóa học. Qua các nhóm và chu kỳ trong bảng tuần hoàn, chúng ta có thể nhận thấy một sự liên kết mạnh giữa sự biến đổi của các tính chất này.
Định luật tuần hoàn đã cho phép chúng ta có cái nhìn tổng thể về tính chất của các nguyên tố hóa học và từ đó, giúp phát triển và tối ưu hóa công nghệ, ứng dụng trong nhiều lĩnh vực khác nhau như y học, công nghệ môi trường, và công nghiệp.
Với sự hiểu biết về sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học và định luật tuần hoàn, chúng ta có khả năng dự đoán và giải thích sự tương tác giữa các nguyên tố trong các hợp chất, khám phá và phát triển những vật liệu mới, và tìm hiểu sâu hơn về cơ chế các quá trình hóa học.
Sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học và định luật tuần hoàn là một kiến thức hóa học cực kì quan trọng đối với các bạn học sinh cấp 3. Vì vậy, hãy cùng Mas.edu.vn tìm hiểu và giải đáp những thắc mắc liên quan đến kiến thức hóa học này bạn nhé!
Danh Mục Bài Viết
Sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học và định luật tuần hoàn
Tính kim loại, tính phi kim
Tính kim loại được xem là một tính chất của một nguyên tố. Mà nguyên tử của nguyên tố đó rất dễ mất electron để trở thành ion dương. Nếu một nguyên tử mà càng dễ mất đi electron thì tính kim loại của nguyên tố đó càng mạnh.
Tính phi kim cũng là một tính chất của nguyên tố. Ngược lại với tính kim loại, tính phi kim là tính mà nguyên tử của nguyên tố đó rất dễ thu electron để trở thành ion âm. Nếu một nguyên tử mà càng dễ thu electron thì tính phi kim của nguyên tố đó càng mạnh.
Tính kim loại, tính phi kim cũng là một trong những sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học. Vậy tính kim loại và tính phi kim biến đổi như thế nào. Hãy cùng theo dõi tiếp bạn nhé!
Sự biến đổi tính kim loại, tính phi kim
Khi nói về sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học và định luật tuần hoàn. Chúng ta sẽ xét theo chu kì (theo chiều tăng dần của điện tích hạt nhân) và xét trong một nhóm (theo chiều từ trên xuống dưới). Chúng sẽ được lập lại ở các chu kì khác, nhóm khác theo cùng một quy luật.
Sự biến đổi của tính kim loại, tính phi kim trong một chu kì theo chiều tăng dần của điện tích hạt nhân. Thì tính kim loại của các nguyên tố yếu dần. Đồng thời tính phi kim của các nguyên tố sẽ tăng dần.
Còn đối với trong một nhóm, theo chiều tăng dần của điện tích hạt nhân. Thì tính kim loại của các nguyên tố tăng dần. Đồng thời tính phi kim của các nguyên tố sẽ yếu dần.
Độ âm điện
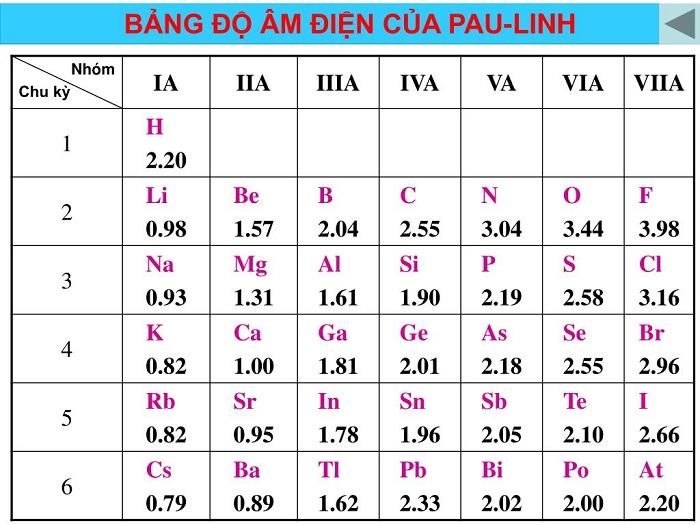
Độ âm điện của một nguyên tử chính là khả năng hút các electron của nguyên tử đó khi hình thành các liên kết hóa học.
Sự biến đổi tuần hoàn tính chất của các nguyên tố hóa, đặc biệt là độ âm điện được mô tả như sau. Độ âm điện của nguyên tử càng lớn thì tính phi kim của nguyên tử đó càng mạnh. Ngược lại, độ âm điện của nguyên tử càng nhỏ thì tính kim loại của nó càng mạnh.
Hóa trị của các nguyên tố
Nếu nói về sự biến đổi tuần hoàn của hóa trị của các nguyên tố thì chúng ta sẽ xét trong một chu kì. Dựa theo bảng tuần hoàn, trong một chu kì khi đi từ trái sang phải. Hóa trị cao nhất với Oxi tăng từ I đến VII, hóa trị đối với hidro giảm từ IV đến I.
Hóa trị đối với hiđro = số thứ tự nhóm – hóa trị đối với oxi.
Chúng ta có công thức phân tử ứng với các nhóm nguyên tố (R : là nguyên tố) như sau:
- R2On: n là số thứ tự của nhóm.
- RH8-n: n là số thứ tự của nhóm.
Sự biến đổi tính Axit-Bazơ của Oxit và Hiđroxit
Sự biến đổi tính Axit-Bazơ của Oxit và Hiđroxit sẽ tương ứng với các nguyên tố ở chu kì 3.
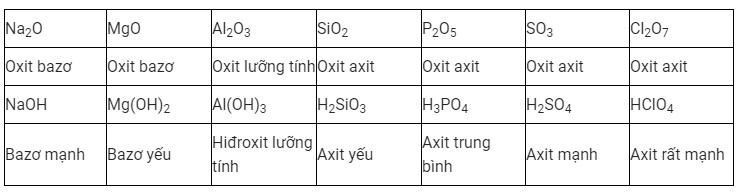
Nếu xét ở một chu kì, chiều của điện tích hạt nhân tăng dần. Tính Bazơ của Oxit và Hiđroxit tương ứng sẽ giảm dần. Đồng thời, tính axit của chúng sẽ tăng dần.
Nếu xét ở một nhóm, điện tích hạt nhân theo chiều tăng dần. Tính Bazơ của Oxit và Hiđroxit tương ứng sẽ tăng dần. Đồng thời, tính axit của chúng sẽ giảm dần.
Từ đó, chúng ta có thể rút ra được một kết luận. Sự biến đổi tính Axit-Bazơ của Oxit và Hiđroxit sẽ phụ thuộc vào chiều tăng dần của điện tích hạt nhân nguyên tử.
Định luật tuần hoàn
Định luật tuần hoàn là định luật mà tính chất của các nguyên tố và đơn chất cũng như thành phần và tính chất của các hợp chất. Nó được tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng dần của điện tích hạt nhân nguyên tử.
Bài viết liên quan:
- Tính chất hóa học của kim loại? 6 ứng dụng kim loại phổ biến nhất
- Tổng hợp 5 tính chất hóa học của bazơ bạn nên biết
- Tính chất hóa học của phenol là gì? Dấu hiệu ngộ độc phenol
- Tính chất hoá học của muối là gì? Bài tập Hoá lớp 9
Một số câu hỏi thường gặp
Sau khi bạn đã hiểu hơn về sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học và định luật tuần hoàn. Thì bây giờ Mas.edu.vn sẽ giải đáp thắc mắc cho bạn về một vài câu hỏi thường gặp nhé!
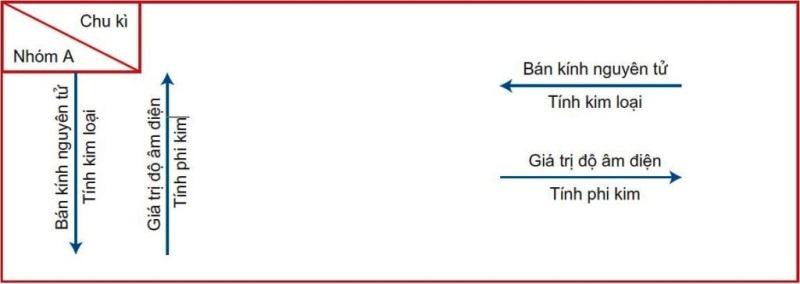
Trong một chu kì, bán kính nguyên tử các nguyên tố như thế nào?
Trong bảng tuần hoàn hóa học, sẽ có 7 chu kì khác nhau. Số thứ tự của chu kì sẽ bằng với số lớp electron. Chu kì nhỏ là chu kì 1,2,3 bao gồm các nguyên tố s và p. Chu kì lớn là chu kì 4,5,6,7 và bao gồm các nguyên tố s,p,d,f.
Nếu xét trong một chu kì và điện tích hạt nhân theo chiều tăng thì bán kính nguyên tử sẽ giảm dần. Bởi vì số electron ngoài cùng tăng dần trong khi đó số lớp electron lại không thay đổi.
Trong một nhóm A, bán kính nguyên tử của các nguyên tố như thế nào?
Nhóm A là nhóm có số thứ tự của nhóm bằng số electron hóa trị. Nhóm A gồm các nguyên tố s và p. Nhóm A là các nguyên tố thuộc phân nhóm chính.
Xét bán kính nguyên tử trong nhóm A, theo chiều tăng của điện tích hạt nhân. Bán kính nguyên tử sẽ tăng dần. Vì số lớp electron tăng dần.
Những tính chất nào biến đổi tuần hoàn?
Trong sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học và định luật tuần hoàn. Những tính chất biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân là:
Bán kính nguyên tử
Trong chu kì, theo chiều tăng của điện tích hạt nhân, bán kính nguyên tử giảm dần. Xét theo nhóm A, theo chiều tăng của điện tích hạt nhân thì bán kính nguyên tử tăng dần.
Độ âm điện
Trong chu kì, theo chiều tăng của điện tích hạt nhân, độ âm điện của nguyên tử tăng dần. Xét theo nhóm A, theo chiều tăng của điện tích hạt nhân, độ âm điện của nguyên tử giảm dần.
Tính phi kim, tính kim loại
Xét theo chu kì, theo chiều tăng của điện tích hạt nhân, tính kim loại giảm dần và tính phi kim tăng dần.Trong nhóm A chiều điện tích hạt nhân tăng, tính kim loại tăng dần và tính phi kim giảm dần.
Tính Axit – Bazơ của Oxit và Hiđroxit
Trong chu kì, theo chiều tăng của điện tích hạt nhân, tính Bazơ giảm dần và tính Axit tăng dần. Xét ở nhóm A, theo chiều tăng của điện tích hạt nhân, tính Bazơ tăng dần và tính Axit dần giảm (trừ nhóm VII).
Độ âm điện của một nguyên tử là gì? Giá trị độ âm điện của nguyên tử các nguyên tố trong các nhóm A biến đổi như thế nào theo chiều điện tích hạt nhân tăng?
Độ âm điện của một nguyên tử là đặc trưng của khả năng hút electron của nguyên tử đó khi hình thành liên kết hóa học. Trong nhóm A theo chiều điện tích hạt nhân tăng. Giá trị độ âm điện của nguyên tử các nguyên tố giảm dần.
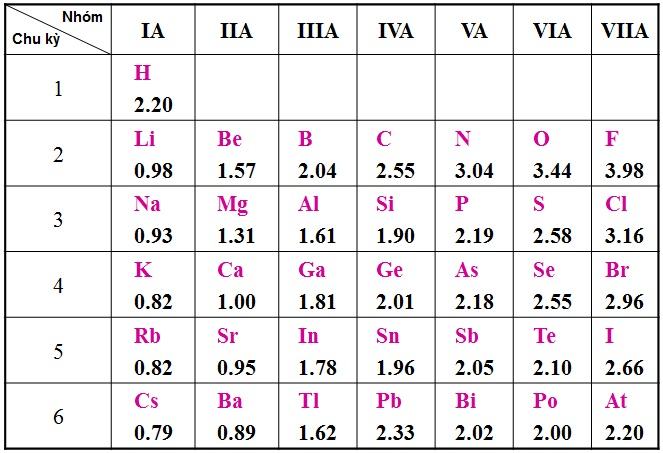
Nguyên tử của nguyên tố nào có giá trị độ âm điện lớn nhất? Tại sao?
Dựa theo bảng độ âm điện của Pauling thì nguyên tố Flo (F) có giá trị độ âm điện lớn nhất. Bởi vì chúng ta có thể dễ dàng thấy rằng nếu xét trong một chu kỳ, theo chiều tăng dần của điện tích hạt nhân thì độ âm điện sẽ tăng dần.
Còn nếu xét trong một nhóm, độ âm điện của các nguyên tử giảm dần từ trên xuống dưới theo chiều điện tích hạt nhân. Từ đó nếu xét cả về chu kì hay theo nhóm thì nguyên tố Flo vẫn luôn có giá trị âm điện lớn nhất.
Trên đây là toàn bộ thông tin liên quan đến sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học và định luật tuần hoàn. Hy vọng qua bài viết này, chúng mình đã có thể giải đáp tất cả những thắc mắc của các bạn về sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học và định luật tuần hoàn. Hãy theo dõi Mas.edu.vn mỗi ngày để cập nhật thêm nhiều thông tin hay bạn nhé!
Sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học là một hiện tượng quan trọng mà định luật tuần hoàn giúp chúng ta hiểu rõ hơn về. Định luật tuần hoàn, còn được gọi là bảng tuần hoàn, đã mang lại những phát hiện đáng kinh ngạc và đưa ra cấu trúc hệ thống để xếp loại và nghiên cứu các nguyên tố hóa học.
Sự biến đổi tuần hoàn tính chất của các nguyên tố được minh họa qua các hạng nguyên tố trên bảng tuần hoàn, trong đó ta thấy sự tăng dần của số nguyên tử, khối lượng nguyên tử và số proton khi di chuyển từ trái sang phải và từ trên xuống dưới. Trên bảng tuần hoàn, các hạng nguyên tố được sắp xếp thành các hàng và cột theo các thuộc tính chung như kích thước, tính kim loại, tính chất hóa học và cấu hình electron.
Sự biến đổi tuần hoàn tính chất của các nguyên tố được giải thích bằng sự trực tiếp tương tác giữa các electron trong nguyên tử. Đặc biệt, các electron ngoại vi ở vùng lớp ngoài cùng của các nguyên tố có vai trò quan trọng trong việc xác định tính chất hóa học của các hợp chất và sự phản ứng. Cấu hình electron cũng đóng vai trò quan trọng trong việc xác định tính chất hóa học của nguyên tố, với các nguyên tử cùng một nhóm có cấu hình electron tương tự.
Định luật tuần hoàn cung cấp cho chúng ta một góc nhìn toàn diện về sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học. Nó cho phép chúng ta khám phá và dự đoán tính chất hóa học và vật lý của các nguyên tố mới dựa trên đặc điểm của các nguyên tố đã biết. Điều này rất hữu ích trong việc phát triển các ứng dụng trong các lĩnh vực như y học, công nghệ và năng lượng.
Tóm lại, sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học là một hiện tượng quan trọng và được giải thích bởi định luật tuần hoàn. Định luật tuần hoàn cung cấp cho chúng ta cái nhìn toàn diện về cấu trúc và tính chất của nguyên tố và giúp chúng ta hiểu rõ hơn về sự biến đổi tuần hoàn tự nhiên của chúng.
Cảm ơn bạn đã xem bài viết Sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học? Định luật tuần hoàn tại Mas.edu.vn bạn có thể bình luận, xem thêm các bài viết liên quan ở phía dưới và mong rằng sẽ giúp ích cho bạn những thông tin thú vị.
Từ Khoá Liên Quan:
1. Tuần hoàn hóa học
2. Nguyên tố hóa học
3. Sự biến đổi tuần hoàn
4. Định luật tuần hoàn Mendeleev
5. Vòng tuần hoàn
6. Tính chất tuần hoàn
7. Biến đổi các nguyên tố hóa học
8. Họ tuần hoàn hóa học
9. Kiểu vòng tuần hoàn
10. Cấu trúc tuần hoàn
11. Đặc điểm tuần hoàn hóa học
12. Tuần hoàn của các chu kỳ hóa học
13. Sự liên quan giữa tuần hoàn và tính chất hóa học
14. Các nhóm tuần hoàn
15. Quá trình biến đổi tuần hoàn