Bạn đang xem bài viết Tính chất hoá học của muối là gì? Bài tập Hoá lớp 9 tại Mas.edu.vn bạn có thể truy cập nhanh thông tin cần thiết tại phần mục lục bài viết phía dưới.
Muối là một chất vô cơ có tính chất hoá học đặc trưng và quan trọng trong cuộc sống hàng ngày của chúng ta. Tính chất hoá học của muối được nghiên cứu và ứng dụng rộng rãi trong lĩnh vực công nghiệp, nông nghiệp, y tế và thực phẩm. Muối cũng là một trong những thành phần cơ bản và không thể thiếu trong hệ thống sinh học của con người và các loài sống khác trên Trái Đất.
Muối có khả năng tạo ra phân cực trong dung dịch và từ đó tham gia vào các phản ứng hóa học quan trọng. Ngoài ra, muối cũng có khả năng liên kết ion với các chất khác, tạo ra các phân tử vô cơ phức tạp. Chính điều này làm cho muối có khả năng thay đổi tính chất hóa học và tạo ra các ứng dụng đa dạng.
Tuy nhiên, một trong những tính chất hoá học quan trọng và đặc trưng nhất của muối chính là khả năng tan trong nước. Muối tan trong nước tạo thành dung dịch muối, có khả năng tạo ra các ion dương và ion âm. Sự phân cực và tính tan của muối là những yếu tố quan trọng làm nên những ứng dụng hóa học và đời sống hàng ngày của muối.
Thông qua việc nghiên cứu tính chất hoá học của muối, chúng ta có thể hiểu sâu hơn về cấu trúc và phản ứng hóa học của các chất vô cơ khác. Việc áp dụng những kiến thức này trong thực tế không chỉ giúp chúng ta tốt hơn trong việc sử dụng muối, mà còn mở ra nhiều cánh cửa mới cho sự phát triển của khoa học hóa học.
Trong đời sống, khi nói đến muối thì đó là một loại gia vị có vị mặn. Tuy nhiên, đối với hóa học, muối có nhiều loại khác nhau. Vậy tính chất hóa học của muối là gì? Cùng Mas.edu.vn khám phá nhé!
Danh Mục Bài Viết
Muối là gì?
Muối là gì?
Trong hóa học, muối là một khái niệm chung dùng để chỉ một hợp chất. Hợp chất của muối gồm nhiều nguyên tử kim loại liên kết với một hay nhiều gốc axit tạo thành.
Cùng Mas.edu.vn tìm hiểu những thành phần và tính chất hoá học của muối kỹ hơn ngay sau đây nhé!

Thành phần hoá học của muối
Thành phần hoá học của muối có công thức hoá học gồm một hay nhiều nguyên tử kim loại (Na,Cu,Al,…) hoặc gốc amoni NH4+ kết hợp với một hay nhiều gốc axit (Cl-,SO42-,PO43-,…).
Tên muối = tên kim loại (thêm hóa trị nếu kim loại có nhiều hoá trị) + tên gốc axit.
Ví dụ:
- Na2SO4: natri sunfat.
- Fe(NO3)3: sắt (III) nitrat.
- KHCO3: kali hiđrocacbonat.
Chú ý:
- – Cl: clorua.
- =S: sunfua.
- = SO3: sunfit.
- = SO4: sunfat.
- =CO3: cacbonat.
- ≡ PO4: photphat.
Phân loại muối
Theo thành phần hoá học của muối có thể chia làm hai loại:
Muối trung hoà:
- Muối trung hoà là muối mà trong gốc axit không có nguyên tử hiđro H có thể thay thế bằng nguyên tử kim loại.
- Ví dụ: Na2SO4, Na2CO3, CaCO3.
Muối axit:
- Muối axit là muối mà trong đó gốc axit của phân tử còn nguyên tử hiđro H chưa được thay thế bằng kim loại.
- Ví dụ: NaHSO4, K2HPO4, Ba(HCO3)2,…
- Hoá trị của gốc axit bằng số nguyên tử hiđro H đã được thay thế bằng kim loại.
Chắc hẳn qua những câu hỏi trên đây bạn đã biết khái niệm và thành phần của muối hóa học. Tiếp tục cùng Mas.edu.vn khám phá chi tiết tính chất hoá học của muối nhé!
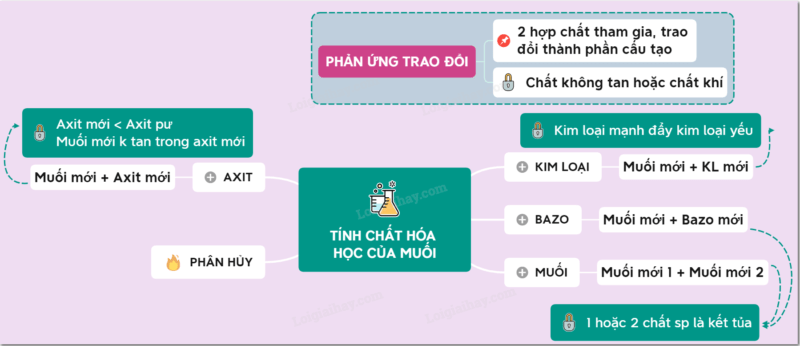
Tính chất hóa học của muối
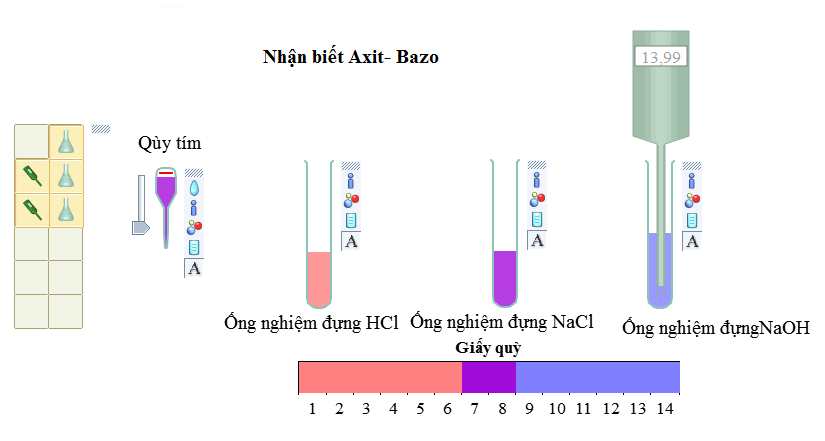
Muối làm đổi màu chất chỉ thị màu
Tính chất hoá học của muối đầu tiên của muối là làm thay đổi màu chất chỉ thị màu.
- Khi kim loại mạnh kết hợp với gốc axit yếu thì dung dịch muối đó sẽ làm đổi màu quỳ tím thành màu xanh. Ví dụ: Na2CO3, KBr, K2CO3,…
- Khi kim loại yếu kết hợp với gốc axit mạnh thì dung dịch muối đó sẽ làm đổi màu quỳ tím thành đỏ. Ví dụ: Ag2SO4,…
- Khi kim loại mạnh kết hợp với một gốc axit mạnh hoặc cả 2 có tính chất ngang nhau thì dung dịch muối đó sẽ không đổi màu quỳ tím. Ví dụ: KNO3, NaCl, CuSO3,…
Kết luận: muối có tính axit mạnh hơn làm quỳ tím hóa đỏ. Nếu tính bazơ mạnh hơn làm quỳ tím hóa xanh và quỳ tím không đổi màu khi muối đó trung tính.
Tác dụng với kim loại
Tính chất hoá học của muối tiếp theo là tác dụng với kim loại. Điều kiện: Kim loại mạnh hơn đẩy kim loại yếu hơn ra khỏi muối.
Muối tác dụng với kim loại → muối mới + kim loại mới. Như K > Na > Ca > Mg > Al > Zn > Fe > Ni > Sn > Pb > H > Cu > Hg > Ag > Pt > Au.
Ví dụ:
- Fe + CuSO4 → FeSO4 + Cu↓.
- Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓.

Phản ứng phân huỷ muối
Tính chất hoá học của muối không chỉ tác dụng với kim loại, axit. Mà bản thân muối cũng có phản ứng phân hủy riêng. Nhiều muối bị phân hủy ở nhiệt độ cao như: KClO3, KMnO4, CaCO3,…
Ví dụ:
- 2KClO3 →t0 2KCl + 3O2.
- CaCO3CaCO3 t0→ CaO + CO2.
Tác dụng với axit
Kế tiếp tính chất hoá học của muối là tác dụng với axit. Điều kiện: Axit mới yếu hơn axit phản ứng hoặc muối mới không tan trong axit mới. Tác dụng với axit → muối mới + axit mới.
Ví dụ:
- BaCl2 + H2SO4 → 2HCl + BaSO4↓.
- CaCO3 + 2HCl → CaCl2 + CO2CO2↑ + H2O.
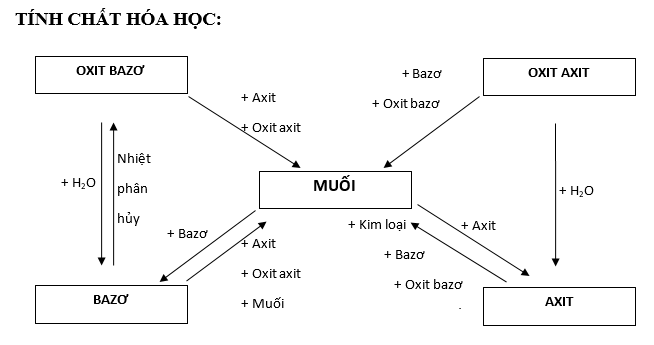
Tác dụng với dung dịch muối
Tính chất hoá học của muối đặc biệt nhất là muối có thể tác dụng với dung dịch muối tạo thành 2 muối mới.
Ví dụ:
- NaCl + AgNO3 → AgCl ↓+ NaNO3.
- Na2SO4 + BaCl2→ BaSO4↓ + 2NaCl.
Tác dụng với dung dịch bazơ
Tính chất hoá học của muối cuối cùng là tác dụng với dung dịch bazơ. Muối có thể tác dụng với dung dịch bazơ tạo thành muối mới và bazơ mới.
Ví dụ:
- Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3↓.
- NaOH + FeSO4 = Fe(OH)2 + Na2SO4.
- NaOH + FeS = Na2S + Fe(OH)2.
Bài viết liên quan:
- Tổng hợp 5 tính chất hóa học của bazơ bạn nên biết
- Tính chất hóa học của axit? 5 ứng dụng axit phổ biến nhất
- Tính chất hóa học của kim loại? 6 ứng dụng kim loại phổ biến nhất
Phản ứng trao đổi dung dịch muối
Phản ứng trao đổi là gì?
Phản ứng trao đổi là phản ứng hóa học. Trong đó hai hợp chất tham gia phản ứng trao đổi với nhau để tạo ra những hợp chất mới. Trong phản ứng trao đổi, số oxi hóa của các nguyên tố trong phản ứng không thay đổi.
Ví dụ:
- NH4NO3 + BaCl2 → NH4Cl + Ba(NO3)2.
- ZnSO4 + MgCl2 + Na3PO4 → ZnCl2 + Mg3PO42 + Na2SO4.
- Na2CO3+CaCl2 →CaCO3 +NaCl.
Điều kiện xảy ra phản ứng trao đổi
Điều kiện để phản ứng trao đổi xảy ra: nếu sản phẩm được tạo thành trong quá trình trao đổi là chất khí hay chất không tan.
Ví dụ:
- K2SO4 + NaOH: Phản ứng không xảy ra.
CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2↓
Lưu ý: phản ứng trung hòa cũng thuộc loại phản ứng trao đổi luôn xảy ra.
Ví dụ:
- H2SO4 + 2NaOH → Na2SO4 + 2H2O.
Một số bài tập về tính chất hoá học của muối lớp 9
Bài 1. Trang 33 Hóa 9 bài 9. Hãy dẫn ra một dung dịch muối khi tác dụng với một dung dịch chất khác thì tạo ra:
- Chất khí.
- Chất kết tủa.
Viết các phương trình hóa học.
Hướng dẫn giải bài 1:
Dựa vào tính chất hoá học của muối, ta có những PTHH sau đây:
Tạo ra chất khí
Ví dụ muối cacbonat (CaCO3, Na2CO3, NaHCO3) hoặc dung dịch muối sunfit (Na2SO3) tác dụng với axit (HCl, H2SO4 loãng):
- CaCO3 + H2SO4 → CaSO4 + CO2 ↑ + H2O.
- Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O.
- Na2SO3 + H2SO4 → Na2SO4 + SO2 ↑ + H2O.
Tạo chất kết tủa
Ví dụ dung dịch muối (BaCl2, Ba(CH3COO)2, Ba(NO3)2,…) tác dụng với dung dịch H2SO4 tạo ra kết tủa BaSO4.
- BaCl2 + H2SO4 → BaSO4 ↓ + 2HCl.
- Ba(CH3COO)2 + H2SO4 → BaSO4 + 2CH3COOH.
Hoặc những dung dịch muối bari tác dụng với dung dịch muối cacbonat (Na2CO3, K2CO3) tạo ra BaCO3 kết tủa.
- Ba(NO3)2 + Na2CO3 → BaCO3 ↓ + 2NaNO3.
Bài 2. Trang 33 Hóa 9 bài 9. Có 3 lọ không nhãn, mỗi lọ đựng một dung dịch muối: CuSO4, AgNO3, NaCl. Hãy dùng những dung dịch có sẵn trong phòng thí nghiệm để nhận biết chất đựng trong mỗi lọ.
Viết các phương trình hóa học và cho biết tính chất hoá học của muối.
Hướng dẫn giải bài 2:
Dựa vào tính chất hoá học của muối, ta có những PTHH sau đây:
Dùng dung dịch NaCl tự pha chế để nhận biết dung dịch AgNO3. Xuất hiện chất kết tủa trắng AgCl.
AgNO3 + NaCl → AgCl ↓ + NaNO3 .
Dùng dung dịch NaOH trong phòng thí nghiệm để nhận biết dung dịch CuSO4 màu xanh lam.
CuSO4 + NaOH → Cu(OH)2 + Na2SO4.
Dung dịch còn lại trong lọ không nhãn là dung dịch NaCl.
Bài 3. Có những dung dịch muối sau: Mg(NO3)2, CuCl2. Vận dụng tính chất hoá học của muối cho biết muối thể tác dụng với những chất nào sau đây:
- Dung dịch NaOH.
- Dung dịch HCl.
- Dung dịch AgNO3.
Nếu có phản ứng, dựa vào tính chất hoá học của muối hãy viết các phương trình hóa học.
Hướng dẫn giải bài 3:
Dựa vào tính chất hoá học của muối, ta có những PTHH sau đây:
- Tác dụng với dung dịch NaOH là dung dịch các muối Mg(NO3)2 và CuCl2 vì sinh ra
- Mg(OH)2 kết tủa, Cu(OH)2 kết tủa.
- Mg(NO3)2 + 2NaOH → Mg(OH)2 ↓ + 2NaNO3.
- CuCl2 + 2NaOH → Cu(OH)2 ↓ + 2NaCl.
- Không muối nào tác dụng với dung dịch HCl.
- Tác dụng với dung dịch AgNO3 là dung dịch muối CuCl2 tạo AgCl kết tủa trắng. PTHH: CuCl2 + 2AgNO3 → 2AgCl ↓ + Cu(NO3)2.

Hy vọng các bạn biết được công thức hóa học của muối cùng một số bài tập về tính chất hoá học của muối lớp 9. Đừng quen share và follow bài viết để Mas.edu.vn có thêm động lực chia sẻ kiến thức nữa nhé.
Tính chất hoá học của muối là các đặc điểm và hiện tượng xảy ra trong quá trình tác dụng của muối với các chất khác. Muối là hợp chất ion gồm cation và anion, được tạo thành từ quá trình trao đổi hoặc chuyển hóa các nguyên tử hoặc nhóm nguyên tử giữa các nguyên tố khác nhau.
Một trong những tính chất hoá học quan trọng của muối là tính chất tạo muối. Muối có khả năng tạo ra các phản ứng tủa hoặc kết tủa khi kết hợp với các chất có khả năng tạo ra cation trung gian hoặc các chất có tính chất oxi-hoá kháng.
Tính chất hoá học khác của muối là tính chất ion hoá. Trong dung dịch, muối phân li thành các ion dương và âm điện. Tính chất ion hoá này đóng vai trò quan trọng trong quá trình dẫn điện của muối. Depend the loại muối, chúng có thể hòa tan tốt hoặc ít hòa tan trong nước.
Ngoài ra, muối còn có tính chất điện li và tính chất oxi-hoá kháng. Tính chất điện li của muối cho phép chúng dẫn điện trong dung dịch, tạo ra hiện tượng phản ứng điện hoá. Tính chất oxi-hoá kháng của muối thể hiện qua khả năng oxi-hoá hoặc kháng oxi-hoá trong các phản ứng hoá học.
Tóm lại, tính chất hoá học của muối là anh hưởng của cấu trúc và thành phần ion của nó trong quá trình tác dụng với các chất khác. Điều này bao gồm tính chất tạo muối, tính chất ion hoá, tính chất điện li và tính chất oxi-hoá kháng. Hiểu về tính chất hoá học của muối là điều quan trọng trong việc áp dụng và hiểu sâu hơn về các quá trình hoá học liên quan đến muối.
Cảm ơn bạn đã xem bài viết Tính chất hoá học của muối là gì? Bài tập Hoá lớp 9 tại Mas.edu.vn bạn có thể bình luận, xem thêm các bài viết liên quan ở phía dưới và mong rằng sẽ giúp ích cho bạn những thông tin thú vị.
Từ Khoá Liên Quan:
1. Muối
2. Tinh thể
3. Hòa tan
4. Điện li
5. Tương đối phân cực
6. Ion
7. Phản ứng ion hóa
8. Tính oxi hoá
9. Tính khử
10. Tính acid
11. Tính bazo
12. Tính bazơ
13. Tính chất vô cơ
14. Tính chất hữu cơ
15. Tương tác phân tử