Bạn đang xem bài viết Tổng hợp công thức hóa học lớp 8 chi tiết nhất tại Mas.edu.vn bạn có thể truy cập nhanh thông tin cần thiết tại phần mục lục bài viết phía dưới.
Công thức hóa học là một phần quan trọng trong môn hóa học. Nó giúp chúng ta biểu diễn cách thức giao hoán của các nguyên tử trong một phản ứng hóa học. Trong lớp 8, chúng ta bắt đầu tiếp cận với các công thức hóa học đơn giản nhưng cần phải nắm vững để có thể nắm vững kiến thức hóa học. Trong bài viết này, chúng ta sẽ tổng hợp các công thức hóa học lớp 8 chi tiết nhất, giúp bạn hiểu rõ hơn về cách thức biểu diễn các phản ứng hóa học và những quy tắc cơ bản trong việc ghi công thức. Chúng ta sẽ đi qua các khái niệm về nguyên tử, phân tử và công thức hóa học đơn giản như công thức hóa học phân tử, công thức hóa học phần tử và quy tắc ghi công thức hóa học. Let’s get started!
Chương trình hóa học lớp 8 xoay quanh kiến thức về chất, nguyên tử, phương trình hóa học,… Bài viết này của Mas.edu.vn sẽ giúp bạn tổng hợp các công thức hóa học lớp 8 đầy đủ nhất!
Danh Mục Bài Viết
Công thức Hóa học lớp 8 cần nhớ
Công thức tính số Mol
Ta có các công thức tính số Mol như sau:
Trong đó:
- m: khối lượng (đơn vị: gam).
- M: khối lượng mol (đơn vị: g/mol).
Công thức này áp dụng cho tính số mol khí ở điều kiện chuẩn.
Trong đó:
- V: thể tích khí ở điều kiện chuẩn (đơn vị: lít).
Công thức này áp dụng cho chất khí.
Trong đó:
- P: áp suất (đơn vị: atm)
- V: thể tích (đơn vị: lít)
- R: hằng số (R = 0,082)
- T: Nhiệt độ kenvin (T = oC + 273)
Trong đó:
- CM: nồng độ dung dịch (đơn vị: mol/ lít).
- Vdd: thể tích dung dịch (đơn vị: lít).
Trong đó:
- N: số nguyên tử hoặc phân tử.
- NA: số avogadro (NA = 6,02.1023).

Công thức tính nồng độ dung dịch
Ta có các công thức tính nồng độ dung dịch/nồng độ mol của dung dịch như sau:
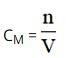
Trong đó:
- n: số mol chất tan (đơn vị: mol).
- V: thể tích dung dịch (đơn vị: lít).
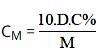
Trong đó:
- D: khối lượng riêng (đơn vị: g/ml)
- C%: nồng độ phần trăm (đơn vị: C%)
- M: khối lượng mol (đơn vị: g/mol)
Công thức tính tỉ khối
- Công thức tính tỉ khối của khí A với khí B:
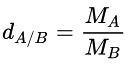
- Công thức tính tỉ khối của khí A với không khí:
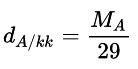
Trong đó:
- D là khối lượng riêng.
- MA; MB lần lượt là khối lượng mol khí A và khí B (đơn vị: g/mol).

Công thức tính thể tích
- Thể tích chất khí ở điều kiện tiêu chuẩn:
V= n x 22,4
- Thể tích của chất rắn và chất lỏng:
![]()
- Thể tích ở điều kiện không tiêu chuẩn:
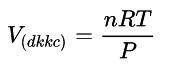
Trong đó:
- P: áp suất (atm)
- R: hằng số (22,4:273)
- T: nhiệt độ: oK (oC+ 273)
Tính thành phần phần trăm về khối lượng của mỗi nguyên tố trong hợp chất
Giả sử hỗn hợp gồm hai chất A và B:

Trong đó:
- mhh; mA; mB lần lượt là khối lượng hỗn hợp, khối lượng chất A, khối lượng chất B (đơn vị: gam).
Tính nồng độ phần trăm
Công thức tính nồng độ phần trăm là một trong những công thức hóa học lớp 8 bạn cần ghi nhớ. Theo đó, ta tính nồng độ phần trăm các chất theo công thức sau:
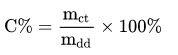
Trong đó:
- mct là khối lượng chất tan.
- mdd là khối lượng dung dịch.
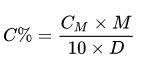
Trong đó:
- CM: nồng độ mol (mol/lít)
- D: khối lượng riêng (g/ml)
- M: khối lượng mol (g/mol)

Độ tan
Công thức tính độ tan như sau:
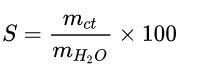
Trong đó:
mct: khối lượng chất tan.
Cách tính nguyên tử khối
Nguyên tử khối của A được tính bằng công thức sau:
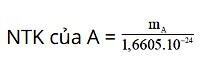
Trong đó:
- mA là khối lượng nguyên tử A (đơn vị gam).
- 1 đvC = 1u = 1,6605.10-27kg = 1,6605.10-24 gam.
Ví dụ:


Định luật bảo toàn khối lượng
Cho phản ứng: A + B → C + D
Áp dụng định luật bảo toàn khối lượng, ta có:
mA + mB = mC + mD
Trong đó:
mA, mB, mC, mD lần lượt là khối lượng của các chất A,B,C,D.
Tính hiệu suất phản ứng
Dựa vào 1 trong các chất tham gia phản ứng:
H%= (Lượng thực tế đã dùng phản ứng : Lượng tổng số đã lấy) x 100%
Dựa vào 1 trong các chất tạo thành
H% = (Lượng thực tế thu được : Lượng thu theo lí thuyết) x 100%
Xem thêm: Tính chất của oxi chương trình lớp 8 – Bài tập minh họa
Các dạng bài tập Hóa học cơ bản lớp 8 – SBT, SGK
Để nắm vững các công thức hóa học lớp 8, mời bạn cùng Mas.edu.vn ôn luyện các dạng bài tập cơ bản trong SBT và SGK nhé!
Công thức Hóa học và tính theo công thức Hóa học
1. Lập công thức hóa học của hợp chất khi biết hóa trị
Các bước để xác định hóa trị như sau:
Bước 1: Viết công thức dạng AxBy
Bước 2: Đặt đẳng thức: x hóa trị của A = y × hóa trị của B.
Bước 3: Chuyển đổi thành tỉ lệ: 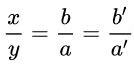
= Hóa trị của B/Hóa trị của A
Chọn a’, b’ là những số nguyên dương và tỉ lệ b’/a’ là tối giản → x = b (hoặc b’); y = a (hoặc a’)
2. Tính thành phần % theo khối lượng của các nguyên tố trong hợp chất AxByCz
Cách 1:
- Tìm khối lượng mol của hợp chất.
- Tìm số mol nguyên tử mỗi nguyên tố trong 1 mol hợp chất rồi quy về khối lượng.
- Tìm thành phần phần trăm các nguyên tố trong hợp chất.
Cách 2: Xét công thức hóa học: AxByCz
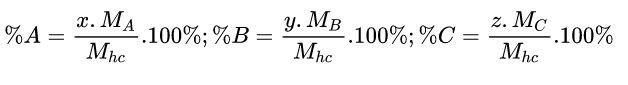 %C có thể được tính theo công thức như sau: %C = 100% – (%A + %B)
%C có thể được tính theo công thức như sau: %C = 100% – (%A + %B)
3. Lập công thức hóa học của hợp chất khi biết thành phần phần trăm (%) về khối lượng
Các bước xác định công thức hóa học của hợp chất:
- Bước 1: Tìm khối lượng của mỗi nguyên tố có trong 1 mol hợp chất.
- Bước 2: Tìm số mol nguyên tử của nguyên tố có trong 1 mol hợp chất.
- Bước 3: Lập công thức hóa học của hợp chất.
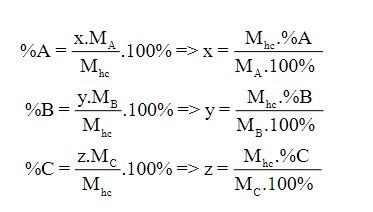
4. Lập công thức hóa học dựa vào tỉ lệ khối lượng của các nguyên tố
a. Bài tập tổng quát:
Cho một hợp chất gồm 2 nguyên tố A và B có tỉ lệ về khối lượng là a:b
Hay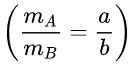
. Tìm công thức của hợp chất.
b. Phương pháp giải
Gọi công thức hóa học tổng quát của 2 nguyên tố có dạng là AxBy. (Ở đây chúng ta phải đi tìm được x, y của A, B. Tìm tỉ lệ: x:y → x, y).
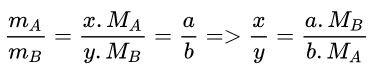
→ Công thức hóa học

Phương trình Hóa học & tính theo phương trình Hóa học
1. Phương trình hóa học
a. Cân bằng phương trình hóa học
a) CuO + H2 → Cu + H2O
b) CO2 + NaOH → Na2CO3 + H2O
c) Zn + HCl → ZnCl2 + H2
d) Al + O2 → Al2O3
e) NaOH + CuSO4 → Cu(OH)2 + Na2SO4
f) Al2O3 + NaOH → NaAlO2 + H2O
g) Fe(OH)3 → Fe2O3 + H2O
h) H3PO4 + Ca(OH)2 → Ca3(PO4)2 + H2O
i) BaCl2 + AgNO3 → AgCl + Ba(NO3)2
k) FeO + H2SO4 → Fe2(SO4)3 + SO2 + H2O
Lời giải chi tiết:
a) CuO + H2 → Cu + H2O
b) CO2 + 2NaOH → Na2CO3 + H2O
c) Zn + 2HCl → ZnCl2 + H2
d) 4Al + 3O2 → 2Al2O3
e) 2NaOH + CuSO4 → Cu(OH)2 + Na2SO4
f) Al2O3 + 2NaOH → 2NaAlO2 + H2O
g) 2Fe(OH)3 → Fe2O3 +3 H2O
h) 2H3PO4 + 3Ca(OH)2 → Ca3(PO4)2 + 3H2O
i) BaCl2 + 2AgNO3 → 2AgCl + Ba(NO3)2
k) 2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
b. Hoàn thành các phương trình hóa học sau:
1) Photpho + khí oxi → Photpho(V) oxit (P2O5)
2) Khí hidro + oxit sắt từ (Fe3O4) → Sắt + Nước
3) Kẽm + axit clohiđric → kẽm clorua + hidro
4) Canxi cacbonat + axit clohidric → canxi clorua + nước + khí cacbonic
5) Sắt + đồng (II) sunfat → Sắt (II) sunfat + đồng
Lời giải chi tiết:
1) Photpho + khí oxi → Photpho(V) oxit (P2O5)
2P + 5O2 → P2O5
2) Khí hidro + oxit sắt từ (Fe3O4) → Sắt + Nước
4H2 + Fe3O4 → 3Fe + 4H2O
3) Kẽm + axit clohiđric → kẽm clorua + hidro
Zn + 2HCl → ZnCl2 + H2
4) Canxi cacbonat + axit clohidric → canxi clorua + nước + khí cacbonic
CaCO3+ 2HCl → CaCl2 + H2O + CO2
5) Sắt + đồng (II) sunfat → Sắt (II) sunfat + đồng
Fe + CuSO4 → FeSO4 + Cu
c. Chọn CTHH thích hợp đặt vào những chỗ có dấu chấm hỏi và cân bằng các phương trình hóa học sau:
1) CaO + HCl → ? + H2
2) P + ? → P2O5
3) Na2O + H2O →?
4) Ba(NO3)2 + H2SO4 → BaSO4 + ?
5) Ca(HCO3)2 → CaCO3 + CO2 + ?
6) CaCO3 + HCl → CaCl2 + ? + H2O
7) NaOH + ? → Na2CO3 + H2O
Lời giải chi tiết:
1) CaO + 2HCl → CaCl2+ H2
2) 4P + 5O2 → 2P2O5
3) Na2O + H2O → 2NaOH
4) Ba(NO3)2 + H2SO4 → BaSO4 + 2HNO3
5) Ca(HCO3)2 → CaCO3 + CO2 + H2O
6) CaCO3 + 2HCl → CaCl2 + CO2 + H2O
7) 2NaOH + CO2 → Na2CO3 + H2O
d. Cân bằng các phương trình hóa học sau chứa ẩn
1) FexOy + H2 → Fe + H2O
2) FexOy + HCl → FeCl2y/x + H2O
3) FexOy + H2SO4 → Fe2(SO4)2y/x + H2O
4) M + H2SO4 → M2(SO4)n + SO2 + H2O
5) M + HNO3 → M(NO3)n + NO + H2O
6) FexOy + H2SO4 → Fe2(SO4)2y/x + SO2 + H2O
Lời giải chi tiết:
1) FexOy + H2 → Fe + H2O
2) FexOy + 2y HCl→ x FeCl2y/x+ y H2O
3) 2FexOy + (6x – 2y) H2SO4 → xFe2(SO4)3 + (3x – 2y) SO2+ (6x – 2y) H2O
4) 2FexOy + (6x – 2y) H2SO4 → xFe2(SO4)3 + (3x – 2y) SO2 + (6x – 2y) H2O
5) (5x – 2y) M + (6nx – 2ny) HNO3 → (5x – 2y)M(NO3)n + nNxOy + (3nx – ny)H2O
6) FexOy + 2y H2SO4 → x Fe2(SO4)2y/x + 2y H2O

2. Tính theo phương trình hóa học
Để làm tốt dạng bài này, bạn cần ghi nhớ các công thức hóa học lớp 8 sau đây:
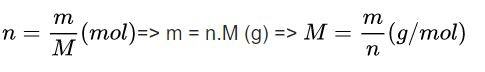
Trong đó:
- n: số mol của chất (mol)
- m: khối lượng (gam)
- M: Khối lượng mol (gam/mol)
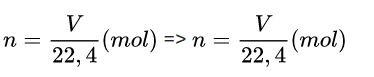
Trong đó:
- V: thể tích chất (điều kiện chuẩn) (lít)
3. Bài toán về lượng chất dư
Giả sử có phản ứng hóa học: aA + bB → cC + dD.
Cho nA là số mol chất A, và nB là số mol chất B
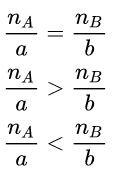
→ A và B là 2 chất phản ứng hết (vừa đủ)
→ Sau phản ứng thì A còn dư và B đã phản ứng hết
→ Sau phản ứng thì A phản ứng hết và B còn dư
Tính lượng các chất theo chất phản ứng hết.
Ví dụ: Cho 6,5 gam kẽm tác dụng với 36,5 g dung dịch HCl. Tính khối lượng muối tạo thành sau phản ứng.
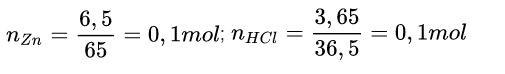
Zn + 2HCl → ZnCl2 + H2
Theo phương trình: 1 mol 2 mol 1 mol
Theo đầu bài : 0,1 mol 0,1 mol 0,05 mol
Xét tỉ lệ:
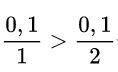
→ Zn dư, Khối lượng các chất tính theo lượng HCl
![]()
Dung dịch và nồng độ dung dịch
1. Các công thức cần ghi nhớ
a. Độ tan
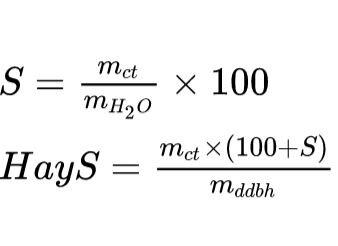
b. Nồng độ phần trăm dung dịch (C%)
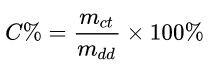
Trong đó:
- mct: khối lượng chất tan (gam)
- mdd: khối lượng dung dịch (gam)
Ví dụ: Hòa tan 15 gam muối vào 50 gam nước. Tình nồng độ phần trăm của dung dịch thu được.
Lời giải chi tiết:
Ta có: mdd = mdm + mct = 50 + 15 = 65 gam
Áp dụng công thức:
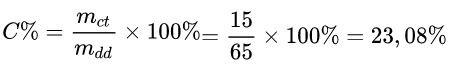
c. Nồng độ mol dung dịch (CM)
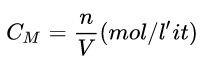
Ví dụ: Tính nồng độ mol của dung dịch khi 0,5 lit dung dịch CuSO4 chứa 100 gam CuSO4
Lời giải chi tiết:
Số mol của CuSO4 = 100 : 160 = 0,625 mol
Nồng độ mol của dung dịch CuSO4 = 0,625 : 0,5 = 1,25M
d. Công thức liên hệ giữa D (khối lượng riêng), mdd (khối lượng dung dịch) và Vdd (thể tích dung dịch):
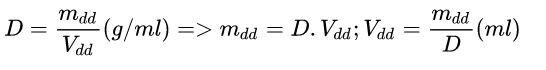

Dưới đây là một số dạng bài tập cơ bản. Mời bạn tham khảo nhé!
Dạng 1: Bài tập về độ tan
Bài tập 1: Ở 20oC, 60 gam KNO3 tan trong 190 nước thì thu được dung dịch bão hoà. Tính độ tan của KNO3 ở nhiệt độ đó ?
Lời giải:
Cứ 190 gam H2O hòa tan hết 60 gam KNO3 tạo dung dịch bão hòa.
100 gam H2O hòa tan hết x gam KNO3.
SKNO3 = (100.60)/190 = 31,58.
Bài tập 2: Ở 20oC, độ tan của K2SO4 là 11,1 gam. Phải hoà tan bao nhiêu gam muối này vào 80 gam nước thì thu được dung dịch bão hoà ở nhiệt độ đã cho?
Lời giải:
20oC: 100g nước hòa tan tối đa 11,1g K2SO4.
Vậy 80 gam nước hòa tan tối đa là:
Số gam muối cần hòa tan: (80.11,1)/100 = 8,88 gam.
Bài tập 3: Tính khối lượng KCl kết tinh được sau khi làm nguội 600 gam dung dịch bão hoà ở 80oC xuống 20oC. Biết độ tan S ở 80oC là 51 gam, ở 20oC là 34 gam.
Lời giải:
Ở 80oC, độ tan của KCl là 51 gam:
151 gam dung dịch bão hòa chứa 51 gam KCl.
⇒ 604 gam → 204 gam
Đặt khối lượng KCl tách ra là a gam.
Ở 20oC, độ tan của KCl là 34 gam:
134 gam dung dịch bão hòa chứa 34 gam KCl.
604 – a gam 204 – a gam
⇒ 34.(604 – a) = 134.(204 – a) ⇒ a = 68 gam
Vậy khối lượng KCl kết tinh được là 68 gam.
Dạng 2: Pha trộn dung dịch xảy ra phản ứng giữa các chất tan với nhau hoặc phản ứng giữa chất tan với dung môi → Ta phải tính nồng độ của sản phẩm (không tính nồng độ của chất tan đó).
Ví dụ: Khi cho Na2O, CaO, SO3,… vào nước, xảy ra phản ứng như sau:
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
Bài tập 1: Cho 6,2 gam Na2O vào 73,8 gam nước thu được dung dịch A. Tính nồng độ của chất có trong dung dịch A?
Lời giải:
nNa2O = 6,2/62 = 0,1 mol
Phương trình hóa học
Na2O + H2O → 2NaOH
0,1 → 0,2 (mol)
mNaOH= 0,2.40 = 8 gam
mdd A = mNa2O + mnước = 6,2 + 73,8 = 80 gam
→ C% NaOH (dd A) = 8/80 .100% = 10%
Bài tập 2: Cho 6,2 gam Na2O vào 133,8 gam dung dịch NaOH có nồng độ 44,84%. Tính nồng độ phần trăm của chất có trong dung dịch?
Lời giải:
nNa2O= 6,2/62 = 0,1 mol
Phương trình hóa học
Na2O + H2O → 2NaOH
⇒nNaOH tạo ra = 0,1.2 = 0,2 mol
nNaOH = (133,8.44,84)/(100.40) = 1,5 mol
⇒nNaOH = 1,5 + 0,2 = 1,7 mol
Theo định luật bảo toàn khối lượng: mNa2O + mdd NaOH = mdd spu = 6,2 + 133,8 = 140 gam
⇒ C%dd = (1,7.40)/140⋅100% = 48,6%

Bài viết trên đây của Mas.edu.vn đã tổng hợp các công thức hóa học lớp 8 chi tiết, đầy đủ nhất. Hy vọng sẽ giúp ích cho bạn trong quá trình học tập. Hẹn gặp bạn ở bài viết sau!
Trên thực tế, tổng hợp công thức hóa học lớp 8 chi tiết nhất đòi hỏi sự kết hợp giữa kiến thức cơ bản và cách tiếp cận sáng tạo của học sinh. Việc này giúp học sinh có thể hiểu sâu về cách xây dựng và phân tích công thức hóa học.
Trong quá trình học hóa học ở lớp 8, học sinh được tiếp cận với các khái niệm cơ bản như átom, nguyên tử, phân tử và các yếu tố, nhóm chính thống của bảng tuần hoàn. Qua việc tìm hiểu và thực hành, học sinh nắm vững cách tính khối lượng molar, tốn tốn ấn định Darwin và quy tắc nguyên tử valence.
Việc tổng hợp công thức hóa học lớp 8 chi tiết nhất yêu cầu học sinh nắm vững luật bảo toàn khối lượng và luật bảo toàn điện tích, đồng thời áp dụng các quy tắc phân tử hóa học. Học sinh cần phải hiểu rõ về cách xác định số oxi hoá của các nguyên tố và tính chất của các phản ứng hóa học.
Tuy nhiên, việc tổng hợp công thức hóa học lớp 8 không chỉ rơi vào việc thuộc lòng các qui tắc và công thức, mà còn cần có khả năng áp dụng linh hoạt và ý thức logic trong quá trình tìm hiểu và phân tích. Trong khi học sinh tiếp cận với các ví dụ thực tế, ví dụ như quá trình cháy của hydrocacbon và phản ứng trao đổi ion, họ sẽ gặp phải những thách thức và phải suy luận, áp dụng kiến thức đã học để hiểu rõ cơ chế của các phản ứng.
Thông qua việc tổng hợp công thức hóa học lớp 8 chi tiết nhất, học sinh có thể xây dựng được nền tảng vững chắc cho việc tiếp tục học tập ở các cấp lớp sau đó. Đồng thời, việc áp dụng các quy tắc và công thức đã được học giúp học sinh phát triển tư duy logic, tăng cường khả năng phân tích và giải quyết vấn đề.
Tóm lại, tổng hợp công thức hóa học lớp 8 chi tiết nhất không chỉ là việc thuộc lòng các qui tắc và công thức, mà còn là sự kết hợp giữa kiến thức cơ bản và kỹ năng sáng tạo của học sinh. Việc này giúp học sinh hiểu sâu và áp dụng linh hoạt kiến thức hóa học trong quá trình học tập và vấn đề thực tế trong cuộc sống.
Cảm ơn bạn đã xem bài viết Tổng hợp công thức hóa học lớp 8 chi tiết nhất tại Mas.edu.vn bạn có thể bình luận, xem thêm các bài viết liên quan ở phía dưới và mong rằng sẽ giúp ích cho bạn những thông tin thú vị.
Từ Khoá Liên Quan:
1. Công thức hóa học
2. Nguyên tử
3. Nguyên tử khối
4. Phân tử
5. Công thức phân tử
6. Đơn chất
7. Hợp chất
8. Ion
9. Ion âm
10. Ion dương
11. Ký hiệu hóa học
12. Công thức hóa đơn giản
13. Đồng phân hóa học
14. Công thức phân tử đầy đủ
15. Công thức hóa hợp chất vô cơ