Bạn đang xem bài viết C là gì trong Hóa học? Tổng hợp các công thức liên quan tại Mas.edu.vn bạn có thể truy cập nhanh thông tin cần thiết tại phần mục lục bài viết phía dưới.
Trong ngành Hóa học, C đại diện cho Carbon (cacbon) – một nguyên tố hóa học quan trọng và phổ biến. Với số nguyên tử 6 và ký hiệu hóa học là C, carbon là nguyên tố không kim loại non, có tầng điện tử ngoài cùng bao gồm 2 electron và 4 electron khuyếch tán. Đặc điểm này đóng vai trò quan trọng và giúp carbon tạo thành nhiều hợp chất hóa học phức tạp.
Các công thức hoá học liên quan đến carbon có thể là hợp chất hữu cơ (có chứa carbon – C) hoặc vô cơ (không chứa carbon – C). Các hợp chất hữu cơ chủ yếu bao gồm cacboxylic acid, este, ancol, amino axit, este béo, hidrocacbon, polime, và các hợp chất hữu cơ tổng hợp khác.
Carbon cũng có thể tạo thành dạng hợp chất vô cơ như cacbon điôxít (CO2), cacbon monoxit (CO), bột than, than cốc, và các muối cacbonat.
Sự đa dạng và khả năng liên kết đa dạng của carbon đã mở ra cánh cửa cho một loạt các ứng dụng và lĩnh vực trong ngành hóa học, bao gồm công nghệ sinh học, dược phẩm, vật liệu và nhiều hơn nữa.
Trong Hóa học, mỗi nguyên tố đều có ký hiệu riêng. Vậy C là gì trong Hóa học? Bài viết dưới đây của Mas.edu.vn sẽ giúp bạn hiểu được khái niệm, các công thức hóa học liên quan để làm bài tập một cách tốt nhất nhé!
Danh Mục Bài Viết
C là gì trong Hoá học?
C là gì trong Hoá học?
Trong bảng tuần hoàn các nguyên tố hóa học, C là ký hiệu của nguyên tố Carbon. C có số nguyên tử bằng 6 và nguyên tử khối bằng 12.
C là một nguyên tố phi kim có hóa trị 4 phổ biến. C tồn tại ở nhiều hình dạng đặc thù nhưng phổ biến nhất là ở dạng cacbon vô định hình, graphit, kim cương và Q – carbon.

C% là gì trong Hoá học?
Trong Hóa học, C% là ký hiệu của nồng độ phần trăm trong dung dịch. Nó cho ta biết số gam chất tan trong 100 gam dung dịch là bao nhiêu.
Với những kiến thức nêu trên, hẳn các bạn đã biết C là gì trong Hóa học. Vậy chúng ta cùng tiếp tục tìm hiểu công thức tính nồng độ phần trăm C ở phần tiếp theo của bài viết nhé!

Xem thêm:
- Z là gì trong Toán học? Tìm hiểu các tập hợp số cơ bản khác
- N là gì trong tiếng Anh? N là viết tắt từ gì trong tiếng Anh
Công thức tính nồng độ phần trăm C
Công thức tính nồng độ phần trăm của một chất được chia làm 2 loại đó là nồng độ phần trăm theo khối lượng và theo thể tích. Hãy cùng Mas.edu.vn tìm hiểu ngay sau đây:
Công thức tính C% theo khối lượng
Nồng độ phần trăm theo khối lượng được định nghĩa là khối lượng của nguyên tố (hay chất tan) chia cho tổng khối lượng của hợp chất (hay dung dịch) và nhân với 100%.
Công thức tính nồng độ phần trăm:
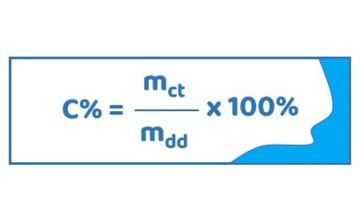
Trong đó,
- C%: Nồng độ phần trăm.
- mct: Khối lượng chất tan.
- mdd: Khối lượng dung dịch.
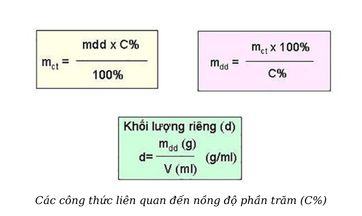
Công thức tính khối lượng dung dịch:
mdd = khối lượng dung môi + khối lượng chất tan
Công thức tính C% theo thể tích
Công thức tính nồng độ phần trăm theo thể tích được tính theo công thức sau:
Nồng độ phần trăm theo thể tích = thể tích chất tan chia cho tổng thể tích dung dịch, nhân với 100%.
Từ công thức tính nồng độ phần trăm, ta có thể suy ra một số công thức tính khác như sau:
Ví dụ: Hòa tan 15 gam NaCl vào 45 gam nước. Tính nồng độ phần trăm của dung dịch thu được.
Ta có:
- mdd = khối lượng dung môi + khối lượng chất tan
Chất tan ở đây là NaCl và dung môi là nước
⇒ mdd = 15 + 45 = 60 gam
- Áp dụng công thức tính nồng độ phần trăm:
C% NaCl = mct / mdd x 100% = 15 / 60 x 100 = 25%
Những lưu ý khi tính nồng độ phần trăm của dung dịch
- Đọc thật kĩ đề bài để xác định được những thành phần đã cho, những thành phần cần phải tìm.
- Nhớ rõ công thức tránh tình trạng nhớ nhầm dẫn đến áp dụng sai.
- Tính toán thật cẩn thận để đưa ra kết quả đúng nhất.
- Nồng độ của dung dịch hầu hết được biểu thị bằng số mol chất tan có trong 1 lít dung dịch.
Bài tập tính nồng độ phần trăm (C%)
Sau đây Mas.edu.vn sẽ hướng dẫn giải một số bài tập vận dụng tính nồng độ phần trăm (C%) để bạn nắm rõ bài hơn nhé!
Bài 1: Hòa tan hết 20 gam HCl vào trong 40 gam nước. Hãy tính nồng độ phần trăm của dung dịch này.
Hướng dẫn giải:
Ta có: HCl là chất tan, dung môi là nước.
Nên khối lượng dung dịch = mct + mdm = 20 + 40 = 60.
Áp dụng công thức: C% = mct / mdd x 100% = 20/60 x 100% = 33,3%.
Vậy nồng độ dung dịch của NaCl là 33,3%.
Bài 2: Tính khối lượng của NaOH có trong 200g dung dịch NaOH 15%.
Hướng dẫn giải:
Áp dụng công thức C% = mct / mdd x 100%, ta có:
C% = mNaOH / 200 x 100 = 15%.
⇒ mNaOH = C% x 200 / 100 = 30 (g).
Bài 3: Tính khối lượng H2SO4 có trong 150 gam dung dịch axit H2SO4 14%.
Hướng dẫn giải:
Ta có: C% = mct / mdd x 100%.
⇒ mct = C% x mdd /100%.
⇔ m(H2SO4) = 14 x 150/100 = 21 (g).
Bài 4: Hòa tan CaCO3 vào 200 gam dung dịch HCl 7,3% (vừa đủ).
a. Viết phương trình hóa học.
b. Tính nồng độ phần trăm của các chất có trong dung dịch sau phản ứng.
Hướng dẫn giải:
a. Phương trình hóa học: CaCO3 + 2HCl → CaCl2 + H2O + CO2↑.
b. Ta có: mHCl = (C% x mdd)/100% = 200 x 7,3/100 = 14,6 (gam).
⇒ nHCl = m/M = 14,6/36,5 = 0,4 mol.
⇒ nCaCO3 = nCaCl2 = nCO2 = ½nHCl = 0,2 mol.
⇒ mCaCO3 = n x M = 0,2 x 100 = 20 gam.
⇒ mCaCl2 = 0,2 x 111 = 22,2 gam, mCO2= 0,2 x 44 = 8,8 gam.
Khối lượng dung dịch sau phản ứng là:
mdd sau phản ứng = mCaCO3 + mdd HCl – mCO2 = 20 + 200 – 8,8 = 211,2 gam.
Vậy nồng độ của CaCl2 là: C% = (22,3 x 100%)/(211 x 2) = 10,51%.

Hy vọng với bài viết trên bạn đọc của Mas.edu.vn đã biết được C là gì trong Hóa học. Trong quá trình học tập nếu có gì thắc mắc, đừng ngần ngại để lại câu hỏi ở phần bình luận, Mas.edu.vn luôn sẵn sàng giải đáp giúp bạn. Chúc các bạn học tốt!
Trong lĩnh vực hóa học, C (carbon) là một nguyên tố hóa học quan trọng với số nguyên tử là 6 và ký hiệu là C trong bảng tuần hoàn. C là một trong những nguyên tố cơ bản của vật chất trên Trái Đất và đóng vai trò quan trọng trong hầu hết các hợp chất hữu cơ.
Carbon là “ngôn ngữ” của không gian và là thành phần chính trong hầu hết các hợp chất hữu cơ, bao gồm các chất tự nhiên như than đá, dầu mỏ, chất hưu cơ sinh học như protein, carbohydrate, lipid và axit nucleic DNA và RNA. Ngoài ra, carbon cũng là thành phần chính trong các polymer như cao su, nhựa, cao su nhiệt và sợi có kết cấu nanomaterial, đồng thời còn có vai trò quan trọng trong ngành công nghệ và ngành công nghiệp.
Công thức liên quan đến carbon có thể là công thức phân tử của các hợp chất hữu cơ, bao gồm các hợp chất cơ bản như metan (CH4), etan (C2H6), anken (CnH
Cảm ơn bạn đã xem bài viết C là gì trong Hóa học? Tổng hợp các công thức liên quan tại Mas.edu.vn bạn có thể bình luận, xem thêm các bài viết liên quan ở phía dưới và mong rằng sẽ giúp ích cho bạn những thông tin thú vị.
Từ Khoá Liên Quan:
1. Cacbon
2. Hợp chất hữu cơ
3. Cường độ liên kết cacbon-hidro
4. Hidrocacbon
5. Carbonat
6. Than đá
7. Chiết xuất từ Cao su
8. Hợp chất vô cơ chứa C
9. Hyđrocacbon
10. Carbon nano
11. BiomolÊct
12. Hợp chất có chứa C
13. Polime C
14. Anđêhit formic
15. Chất công nghiệp từ C.