Bảng tuần hoàn các nguyên tố hóa học là một trong những chuyên đề trọng điểm của môn Hóa học trong chương trình trung học cơ sở và trung học phổ thông. Tuy nhiên để bạn ghi nhớ và áp dụng tốt bảng tuần hoàn các nguyên tố cần phải cần đến một phương pháp học hay. Sau đây là tổng hợp bảng tuần hoàn các nguyên tố hóa học 8 9 10 mới nhất cùng cách học hiệu quả.
Danh Mục Bài Viết
Bảng tuần hoàn là gì?
Bảng tuần hoàn hay bảng tuần hoàn các nguyên tố hóa học rất quen thuộc đối với mỗi bạn học sinh, sinh viên hay những ai làm trong lĩnh vực nghiên cứu hóa học. Đây là một phương pháp giúp liệt kê các nguyên tố hóa học thành bảng dựa trên số hiệu nguyên tử (số proton trong hạt nhân), cấu hình electron cùng các tính chất hóa học đặc trưng của chúng.
Có nhiều dạng bảng nguyên tố khác nhau, nhưng ở nước ta chủ yếu sử dụng bảng cổ điển ở dạng ô, trong đó các nguyên tố hóa học được sắp xếp theo số proton mà mỗi nguyên tố có trong hạt nhân nguyên tử của nó.
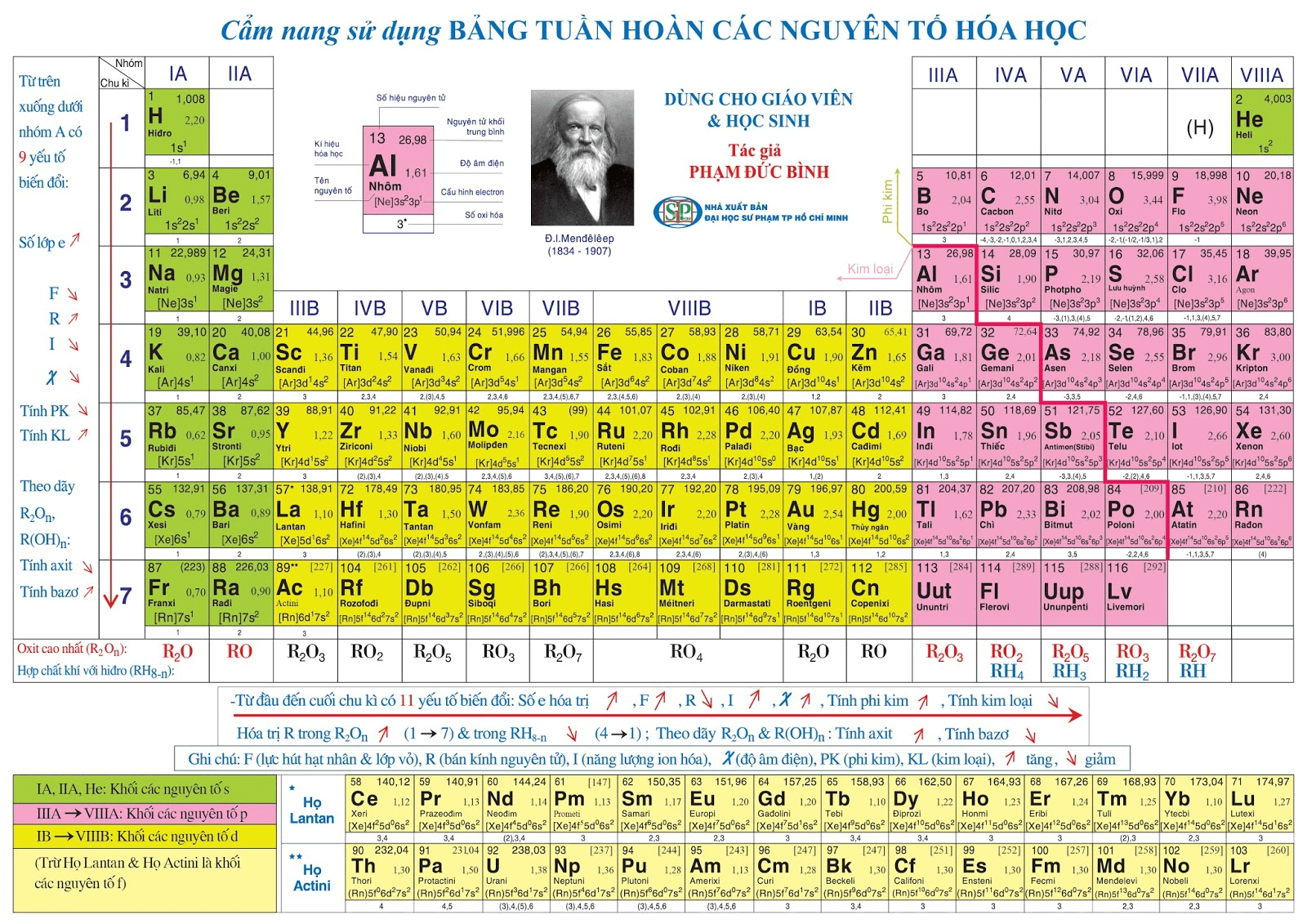
Bảng tuần hoàn là gì
Tìm hiểu ý nghĩa bảng tuần hoàn hóa học
Có thể bạn chưa biết, bảng tuần hoàn hóa học ra đời có ý nghĩa rất lớn đối với sự phát triển của nhân loại. Không chỉ là một tài liệu rất cần thiết phục vụ trong học tập mà nó còn được ứng dụng trong các công trình nghiên cứu, chứa đựng cả kho tàng thông tin hữu ích. Không chỉ được ứng dụng trong nhiều ngành khác nhau, nó còn tạo tiền đề cho sự phát triển mạnh mẽ của lĩnh vực nguyên tử.
Cụ thể như sau:
- Nếu biết vị trí của một nguyên tố trong bảng tuần hoàn, từ đó biết được cấu tạo của nguyên tố đó và ngược lại.
Ví dụ: Nguyên tố ở STT 20, chu kỳ 4 và thuộc nhóm IIA thì có thể xác định được nguyên tố đó là Ca, có 20p, 20e trong nguyên tử và có 4 lớp e với số e lớp ngoài cùng là 2.
- Khi biết vị trí của nguyên tố trong bảng, có thể hiểu được những tính chất hóa học cơ bản của nó.
- Dựa vào quy luật biến đổi tính chất của các nguyên tố có trong bảng, ta cũng có thể so sánh tính chất hóa học của một nguyên tố với các nguyên tố lân cận khác.

Tìm hiểu ý nghĩa bảng tuần hoàn hóa học
Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Hiện tại, bảng hệ thống tuần hoàn hóa học đã hoàn thiện với 118 nguyên tố. Các nguyên tố sẽ được sắp xếp từ trái qua phải, từ trên xuống dưới theo quy luật thứ tự tăng dần số hiệu nguyên tử. Vậy cấu tạo của bảng tuần hoàn các nguyên tố hóa học gồm có những gì?
Ô nguyên tố
Mỗi nguyên tố hóa học được xếp vào một ô của bảng gọi là ô nguyên tố. Số thứ tự của ô nguyên tố bằng số hiệu nguyên tử của nguyên tố đó.
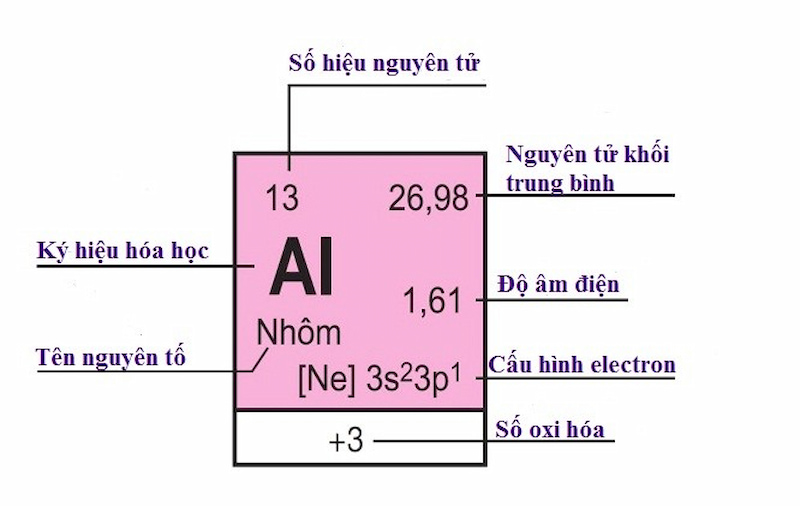 Số thứ tự của ô nguyên tố bằng số hiệu nguyên tử của nguyên tố đó. (Ảnh: Sưu tầm Internet)
Số thứ tự của ô nguyên tố bằng số hiệu nguyên tử của nguyên tố đó. (Ảnh: Sưu tầm Internet)
Ví dụ:
Nhôm (Al) chiếm ô 13 trong bảng tuần hoàn, vậy:
-
Số hiệu nguyên tử của Al là 13, số đơn vị điện tích hạt nhân là 13.
-
Số đơn vị điện tích hạt nhân là 13
-
Trong hạt nhân có 13 proton và vỏ nguyên tử của Al có 13 e.
Chu kì
Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được sắp xếp theo chiều điện tích hạt nhân tăng dần.
Trong bảng tuần hoàn gồm 7 chu kỳ:
-
Chu kì 1: Gồm 2 nguyên tố H (Z=1) đến He (Z=2).
-
Chu kì 2: Gồm 8 nguyên tố Li (Z=3) đến Ne (Z=10).
-
Chu kì 3: Gồm 8 nguyên tố Na (Z=11) đến Ar (Z=18).
-
Chu kì 4: Gồm 18 nguyên tố K (Z=19) đến Kr (Z=36).
-
Chu kì 5: Gồm 18 nguyên tố Rb (Z=37) đến Xe (Z=54).
-
Chu kì 6: Gồm 32 nguyên tố Cs (Z=55) đến Rn (Z=86).
-
Chu kì 7: Bắt đầu từ nguyên tố Fr (Z=87) đến nguyên tố có Z=110, đây là một chu kì chưa hoàn thành.
Phân loại chu kì
-
Chu kì nhỏ: Các chu kì 1,2,3.
-
Chu kì lớn: Các chu kì 4,5,6,7.
Như vậy, chu kỳ được bắt đầu bằng 1 kim loại kiềm và kết thúc bằng 1 khí hiếm. Số thứ tự của chu kỳ bằng số lớp electron trong nguyên tử.
Lưu ý: Hai hàng cuối bảng là 2 họ nguyên tố có cấu hình e đặc biệt:
-
Họ Lantan: Gồm 14 nguyên tố đứng sau La(Z=57) thuộc chu kì 6.
-
Họ Actini: Gồm 14 nguyên tố sau Ac(Z=89) thuộc chu kì 7.
Nhóm nguyên tố
Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được sắp xếp thành một cột.
Bảng tuần hoàn các nguyên tố hóa học được phân loại thành 8 nhóm A (đánh số từ IA đến VIIIA) và 8 nhóm B (đánh số từ IB đến VIIIB). Trong đó, mỗi nhóm là một cột, riêng nhóm VIIIB gồm 3 cột. Nguyên tử các nguyên tố trong cùng một nhóm có số electron hóa trị bằng nhau và bằng số thứ tự của nhóm (trừ hai cột cuối của nhóm VIIIB).
Nhóm A:
-
Nhóm A gồm 8 nhóm từ IA đến VIIIA.
-
Các nguyên tố nhóm A gồm nguyên tố s và nguyên tố p:
Nguyên tố s: Nhóm IA (nhóm kim loại kiềm, trừ H) và nhóm IIA (kim loại kiềm thổ).
Nguyên tố p: Nhóm IIIA đến VIIIA (trừ He).
-
STT nhóm bằng số e lớp ngoài cùng và bằng số e hóa trị
Cấu hình electron hóa trị tổng quát của nhóm A:
⟶ nsanpb
⟶ ĐK: 1≤a≤2; 0≤b≤6
Số thứ tự của nhóm A=a+b
⟶ Nếu a+b≤3 ⇒ Kim loại
⟶ Nếu 5≤a+b≤7 ⇒ Phi kim
⟶ Nếu a+b=8 ⇒ Khí hiếm
Ví dụ:
⟶Na(Z=11):1s22s22p63s1⇒IA
⟶O(Z=8):1s22s22p4⇒VIA
Nhóm B:
Nhóm B gồm 8 nhóm được đánh số từ IIIB đến VIIIB, IB và IIB theo chiều từ trái sang phải trong bảng tuần hoàn.
-
Nhóm B chỉ gồm các nguyên tố của các chu kỳ lớn.
-
Nhóm B gồm các nguyên tố d và nguyên tố f (thuộc 2 hàng cuối bảng).
-
STT nhóm bằng số e lớp ngoài cùng và bằng số e hóa trị (Trường hợp ngoại lệ: Số e hóa trị = 9, 10 thuộc nhóm VIIIB)
Cấu hình electron hóa trị tổng quát của nhóm B:
⟶ (n−1)dansb
⟶ ĐK: b=2; 1≤a≤10
Số thứ tự của nhóm:
⟶ Nếu a+b < 8 ⇒ STT nhóm = a+b
⟶ Nếu a+b = 8,9,10 ⇒ STT nhóm = 8
⟶ Nếu a+b > 10 ⇒ STT nhóm = (a+b)−10
>> Xem bảng tuần hoàn các nguyên tố hóa học đầy đủ, rõ nét nhất: TẠI ĐÂY
Sự biến đổi tính chất của các nguyên tố trong bảng tuần hoàn hóa học
Trong một chu kì (theo chiều tăng của điện tích hạt nhân) và trong một nhóm (theo chiều từ trên xuống dưới) có sự biến đổi tính chất được lặp lại ở các chu kì khác, nhóm khác theo cùng quy luật dưới đây.
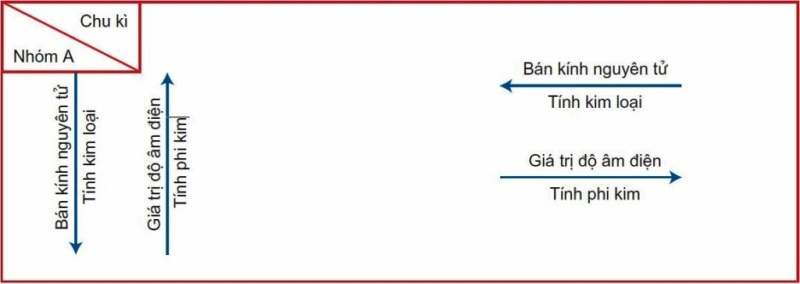 Sự biến đổi tính chất của nguyên tố trong hệ thống bảng tuần hoàn các nguyên tố hóa học. (Ảnh: Sưu tầm Internet)
Sự biến đổi tính chất của nguyên tố trong hệ thống bảng tuần hoàn các nguyên tố hóa học. (Ảnh: Sưu tầm Internet)
Trong một chu kì
Trong một chu kì, khi đi từ đầu chu kì đến cuối chu kì theo chiều tăng dần của điện tích hạt nhân, các nguyên tố trong bảng tuần hoàn hóa học có sự biến đổi như sau:
-
Số electron lớp ngoài cùng của nguyên tử tăng dần từ 1 đến 8 electron.
-
Tính kim loại của các nguyên tố giảm dần, đồng thời tính phi kim của các nguyên tố tăng dần. Đầu chu kì là một kim loại kiềm, cuối chu kì là halogen, kết thúc chu kì là một khí hiếm.
Ví dụ:
Trong chu kì 2, 3 ta nhận thấy:
-
Chu kì 2: Gồm 8 nguyên tố.
-
Số electron lớp ngoài cùng của nguyên tử các nguyên tố trong chu kì 2 tăng dần từ 1 đến 8 (Li ở nhóm I, Ne ở nhóm VIII).
-
Tính kim loại giảm dần và tính phi kim tăng dần: Đầu chu kì là một kim loại mạnh (Li), cuối chu kì là một phi kim mạnh (F), kết thúc chu kì là một khí hiếm (Ne).
|
Nhóm |
IA Na |
IIA Mg |
IIIA Al |
IVA Si |
VA P |
VIA S |
VIIA Cl |
|
Tính Chất |
Kl điển hình |
Kl mạnh |
Kl |
Pk yếu |
Pk TB |
Pk mạnh |
Pk điển hình |
|
Kim loại |
Phi kim |
||||||
Ngoài ra, trong một chu kì, các nguyên tố trong bảng tuần hoàn hóa học còn có sự biến đổi tính chất:
-
Độ âm điện: Tăng dần trong một chu kì, đi từ trái sang phải theo chiều tăng dần của điện tích hạt nhân. Như vậy, độ âm điện của các nguyên tố biến đổi theo chiều tăng dần của Z+.
(Độ âm điện của một nguyên tử là đại lượng đặc trưng cho khả năng hút electron của nguyên tử đó khi tạo thành liên kết hóa học.)
-
Tính bazơ của các oxit và hiđroxit: Giảm dần theo chiều tăng của điện tích hạt nhân, đồng thời tính axit của chúng tăng dần.
-
Hóa trị: Trong cùng chu kì, khi điện tích hạt nhân tăng, hóa trị cao nhất với oxi tăng từ 1 đến 7, hóa trị đối với hidro giảm từ 4 đến 1. Như vậy, hóa trị cao nhất của một nguyên tố với oxi, hóa trị với hiđro biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân.
Hóa trị đối với hidro = số thứ tự nhóm – hóa trị đối với oxi
-
Bán kính nguyên tử: Giảm dần theo chiều tăng của điện tích hạt nhân.
-
Năng lượng ion hóa: Tăng dần theo chiều tăng của điện tích hạt nhân.
Trong một nhóm
Trong một nhóm, khi đi từ trên xuống dưới theo chiều tăng của điện tích hạt nhân: Số lớp electron của nguyên tử tăng dần, tính kim loại của các nguyên tố tăng dần đồng thời tính phi kim của các nguyên tố giảm dần.
Ví dụ:
Trong nhóm I và nhóm VII, ta quan sát được:
Nhóm I: Gồm 6 nguyên tố từ Li đến Fr.
-
Số lớp electron tăng dần từ 2 đến 7.
-
Số electron lớp ngoài cùng của nguyên tử đều bằng 1.
-
Tính kim loại của các nguyên tố tăng dần: Đầu nhóm, Li là kim loại mạnh, đến cuối nhóm Fr là kim loại cực mạnh.
Nhóm VII: Gồm 5 nguyên tố từ 5 đến At
-
Số lớp electron tăng dần từ 2 đến 6.
-
Số electron lớp ngoài cùng của nguyên tử đều bằng 7.
-
Tính phi kim giảm dần: Đầu nhóm, F là phi kim hoạt động hoá học rất mạnh. Đến cuối nhóm, I là phi kim hoạt động hoá học yếu hơn, At là nguyên tố không có trong tự nhiên nên ít được nghiên cứu.
| Nhóm | IA
Na |
IIA
Mg |
IIIA
Al |
IVA
Si |
VA
P |
VIA
S |
VIIA
Cl |
| Tính chất | Kl điển hình | Kl mạnh | Kl | Pk yếu | Pk trung bình | Pk mạnh | Pk điển hình |
| Kim loại (Kl) | Phi kim (Pk) | ||||||
Ngoài ra, trong một nhóm sắp xếp theo chiều tăng dần của điện tích hạt nhân, các nguyên tố trong bảng tuần hoàn hóa học còn có sự biến đổi tính chất như sau:
-
Độ âm điện: Giảm dần trong một nhóm, đi từ trái sang phải theo chiều tăng dần của điện tích hạt nhân.
-
Tính bazơ của các oxit và hiđroxit: Tăng dần theo chiều tăng của điện tích hạt nhân, đồng thời tính axit của chúng giảm dần.
-
Bán kính nguyên tử: Tăng dần theo chiều tăng của điện tích hạt nhân.
-
Năng lượng ion hóa: Giảm dần theo chiều tăng của điện tích hạt nhân.
Hướng dẫn cách đọc bảng tuần hoàn hóa học dễ hiểu nhất
- Trước tiên, ta cần hiểu ở trong bảng tuần hoàn các nguyên tố hóa học được sắp xếp theo thứ tự số hiệu nguyên tử tăng dần.
- Các nguyên tố sẽ được ký hiệu sắp xếp trong mỗi ô.
- Một bảng chuẩn gồm có 18 cột, 7 dòng, 2 dòng kép nằm riêng bên dưới là họ Lantan và họ Actini.
Sau đây, để đọc được bảng tuần hoàn ta cần lưu ý:
Cần hiểu rõ về cấu trúc của bảng
- Được bắt đầu từ bên trái phía trên và kết thúc ở cuối hàng cuối cùng, nằm gần phía dưới bên phải.
- Tuy nhiên, không phải hàng hay cột nào cũng chứa đủ các nguyên tố. Do đó, nếu bắt gặp ô trống ở giữa, chúng ta vẫn tiếp tục đọc bảng tuần hoàn từ trái sang phải.
- Các nguyên tố có cùng cấu hình e lớp ngoài cùng sẽ được sắp xếp theo cột đứng và được gọi là nhóm nguyên tố. Trong cùng một nhóm, chúng ta sẽ đọc từ trên xuống dưới. Số nhóm có thường được đánh ở trên các cột, ở một vài nhóm khác lại được đánh số phía dưới. Cách đánh số có thể sử dụng chữ số La Mã, hoặc Ả Rập hay con số từ 1-18.
- Với các nguyên tố sắp xếp theo chiều điện tích hạt nhân tăng dần và có cùng số lớp trong lớp vỏ e, được gọi là chu kỳ bảng tuần hoàn. Cụ thể, có 7 chu kỳ được đánh số từ 1 đến 7 ở bên trái của bảng và trong một chu kỳ thì được đọc theo chiều từ trái sang phải trong đó chu kỳ sau sẽ lớn hơn chu kỳ trước.
- Cần hiểu được cách phân loại màu sắc cho các nhóm kim loại, á kim hay phi kim.
- Đôi khi các nguyên tố hóa học cũng được sắp xếp thành từng họ.
Đọc được ký hiệu hóa học cùng tên nguyên tố
- Ta cần đọc ký hiệu hóa học trước, nó là sự kết hợp của 1 hay 2 chữ cái được thống nhất sử dụng.
- Đọc tên thông thường của nguyên tố, nó được đặt ngay dưới ký hiệu hóa học và sẽ được thay đổi phù hợp với ngôn ngữ của bảng tuần hoàn.
Đọc số hiệu nguyên tử
- Đọc bảng tuần hoàn hóa học theo số hiệu nguyên tử nằm ở giữa bên trên hoặc ở trên bên trái của mỗi ô nguyên tố (ô nguyên tố bao gồm tên nguyên tố, kí hiệu hóa học, số hiệu nguyên tử, nguyên tử khối trung bình, độ âm điện, cấu hình electron và số oxi hóa). Số hiệu nguyên tử sẽ được sắp xếp tăng dần theo chiều từ góc trái bên trên sang góc phải bên dưới (Nó là số proton có trong hạt nhân nguyên tử của nguyên tố đó).
- Việc thêm bớt các proton sẽ tạo thành nguyên tố khác.
- Khi tìm ra số proton cũng sẽ tìm được số electron trong nguyên tử đó, vì số proton và số electron bằng nhau trong một nguyên tử trừ một số trường hợp đặc biệt. Dấu trừ và cộng bên cạnh ký hiệu hóa học tương ứng điện tích âm và dương
Đọc trọng lượng nguyên tử
- Trọng lượng nguyên tử là số được ghi bên dưới tên nguyên tố và được biểu thị hầu hết dưới dạng thập phân.
- Từ trọng lượng nguyên tử có thể tìm được số nơtron có trong nguyên tử bằng cách: làm tròn trọng lượng nguyên tử đến số nguyên gần nhất trừ đi số proton sẽ được số nơtron.
Hướng dẫn cách đọc bảng tuần hoàn hóa học dễ hiểu nhất
3 mẹo giúp ghi nhớ lâu bảng tuần hoàn nguyên tố
Nếu bạn thấy việc hiểu và nhớ bảng tuần hoàn còn gặp nhiều khó khăn, hãy thử áp dụng một số mẹo dưới đây. Rất nhiều bạn áp dụng cách này đã thành công để hiểu hơn về chúng:
- Bạn có thể chuyển các nguyên tố thành thơ hay câu nói dễ nhớ, quen thuộc với mình.
- Nhớ được dãy hóa trị.
- Hãy thử in ra một bản màu dán ở nơi thường xuyên nhìn thấy.
- Thường xuyên làm các công việc cần vận dụng bảng tuần hoàn để có thể hiểu và nhớ chúng lâu hơn.

Ví dụ về mẹo giúp ghi nhớ lâu bảng tuần hoàn nguyên tố
Thực tế, bảng tuần hoàn các nguyên tố hóa học 10 có khá nhiều thông tin. Hãy áp dụng 1 trong 3 cách sau để việc học thuộc và ghi nhớ trở nên đơn giản và nhanh chóng hơn.
Cách 1: Nghiên cứu bảng tuần hoàn
Mỗi ô trong bảng tuần hoàn sẽ hiển thị thông tin về tên, ký hiệu, số hiệu nguyên tử. Chỉ cần ghi nhớ 10 nguyên tố đầu tiên, các em sẽ tìm ra quy luật cho các nguyên tố còn lại.
Cách 2: In và dán bảng tuần hoàn ở những nơi dễ nhận thấy trong không gian học
 Cách học thuộc nhanh bảng tuần hoàn (Nguồn: Internet)
Cách học thuộc nhanh bảng tuần hoàn (Nguồn: Internet)
Các em hãy dán bảng tuần hoàn ở những nơi dễ quan sát và chia thành nhiều phần để học. Điều này thật sự mang đến hiệu quả cao trong việc ghi nhớ.
Cách 3: Dùng phương pháp để ghi nhớ
Để có thể nhớ lâu kiến thức trong bảng tuần hoàn, các em cần thường xuyên làm bài tập và áp dụng câu thơ/văn xuôi để ghi nhớ:
Hơn hết, để có thể nhớ lâu kiến thức trong bảng tuần hoàn nguyên tố hóa học, các em cần thường xuyên làm bài tập và áp dụng câu thơ/văn xuôi để ghi nhớ 20 nguyên tố đầu:
Hoàng hôn lặn bể Bắc
Chợt nhớ ở phương Nam
Nắng mai ánh sương phủ
Song cửa ai không cài.
| H Hoàng |
He Hôn |
||||||
| Li Lặng |
Be Bể |
B Bắc |
C Chợt |
N Nhớ |
O Ở |
F Phương |
Ne Nam |
| Na Nắng |
Mg Mai |
Al Ánh |
Si Sương |
P Phủ |
S Song |
Cl Cửa |
Ar Ai |
| K Không |
Ca Cài |
Hoặc một số câu nói học thuộc như: “khi nào cần may áo giáp sắt nhớ sang phố hỏi cửa hàng Á Phi Âu” tương ứng cho F, Na, Ca, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au. “Lâu nay không rảnh coi phim” tương ứng với Li, Na, K, Rb, Cs, Pr.
Cách 4: Bài ca hóa trị
Áp dụng bài ca hóa trị để học thuộc bảng tuần hoàn các nguyên tố hóa học:
- “Kali, I – ốt, Hidro
- Natri với Bạc, Clo một loài
- Là hóa trị 1 bạn ơi
- Nhớ ghi cho rõ kẻo rồi phân vân
- Magie, Chì, Kẽm, Thủy ngân
- Canxi, Đồng ấy cũng gần Bải
- Cuối cùng thêm chú Oxi
- Hóa trị 2 ấy có gì khó khăn
- Bác Nhôm hóa trị 3 lần
- Ghi sâu trí nhớ khi cần có ngay
- Cacbon, Silic này đây
- Là hóa trị 4 không ngày nào quên
- Sắt kia kể cũng quen tên
- 2, 3 lên xuống thật phiền lắm thôi
- Nito rắc rối nhất đời
- 1, 2, 3, 4 khi thời thứ 5
- Lưu huỳnh lắm lúc chơi khăm
- Xuống 2, lên 51 khi nằm thứ 4
- Photpho nói tới không dư
- Nếu ai hỏi đến thì hừ rằng 5
- Em ơi cố gắng học chăm
- Bài ca hóa trị suốt năm rất cần”.
Như vậy, bài viết này của Thợ Chữ đã cung cấp cho bạn tổng hợp kiến thức về bảng tuần hoàn các nguyên tố hóa học 8 9 10 mới nhất cùng cách ghi nhớ hiệu quả. Hy vọng qua những thông tin trên, bạn có thể học thuộc lòng hiệu quả bảng tuần hoàn các nguyên tố và vận dụng chúng để giải thành thạo bài tập trong các kỳ thi quan trọng.